|
|
Поверхностные центры кислотного и основного типаАтомы на поверхности твердого тела и адсорбата можно характеризовать также с помощью понятий кислотно-основных связей, введенных Бренстедом и Льюисом. Кислотный поверхностный центр Льиюса представляет собой центр, принимающий электронную пару с участием адсорбента, что приводит к уменьшению общей энергии системы. Основной поверхностный центр Льюиса отдает электронную пару. Кислотный центр Бренстеда на поверхности отдает протон, а основной центр Бренстеда его принимает. Тогда сила кислоты или кислотность центра Бренстеда на поверхности твердого тела характеризуется способностью этого центра сдвигать вправо реакцию Н+ + В = ВН+ (5.4) где В — молекула основания, ВН+ — сопряженная ей кислота, Н+ — характерный для центра Бренстеда протон. Константа равновесия [ВН+] / [В] · [Н+] = К (5.5) характеризует способность основания переходить в кислую форму. Концентрация компонентов соответствует lg K = - pK (5.6) Кислотность поверхностного центра Н0 Н0 = - lg [Н+] (5.7) Отношение основной и кислотной форм адсорбированного основания выражается через кислотность поверхностных центров Бренстеда. lg { [В] / [ВН+] =Н0 – pК (5.8) Аналогично определяется кислотность Но кислотного центра Льюса Н0 = lg а А (5.9) где а А — активность акцептора электронной пары. Отношение основной и кислотной форм адсорбированного основания выражается через кислотность Льюиса Н0 lg { [В] / [АВ] =Н0 – pК (5.10) где В — основание, АВ — форма основания с обобщенной электронной парой. До сих пор рассматривались микроскопические аспекты, не связанные с процессами на поверхности твердых тел. Далее будут рассмотрены эффекты поверхности, характеризующие ее превращения под действием таких важных явлений, как адсорбция и катализ. Адсорбция Адсорбция атомов и молекул определяет основные свойства поверхности. Чистые монокристаллические поверхности, рассматриваемые ранее, создаются при условиях высокого вакуума. Если считать, что монослой поверхности включает 1015 ат/см2, то монослой адсорбированных молекул создается практически мгновенно. В соответствии с кинетической газов число соударений молекул газа массой М при давлении р (Па) и температуре Т на поверхности площадью 1 см2 за 1 с дается выражением N = p / (2πMkT)1/2 (5.11) что дает простое оценочное выражение при комнатной температуре N = 2- 1019p/М1/2 см2с-1. При р = 10-6 Па (10-8 Торр) поверхность покрывается монослоем газа (М ≈ 20 ÷ 30) за 102 ÷ 103 с. Таким образом, вакуум 10-9 Торр можно считать в некотором роде отсчетом, когда за реальные времена адсорбции не происходит. Принято различать два типа адсорбции - физическую и химическую, хотя существуют и промежуточные формы. В процессе физической адсорбции молекулы связываются с поверхностью силами Ван-дер-Ваальса, при химической (хемосорбции) — силами химического взаимодействия. Физическая сорбция обратима, в то время как хемосорбция может быть и необратимой. Кроме того, значения теплот хемосорбции, характеризующие силу связи молекулы с поверхностью, значительно выше (единицы и десятки кДж/моль) по сравнению с физической сорбцией (доли и единицы кДж/моль). Повышение температуры может переводить частично физическую сорбцию в хемосорбцию, если тепловая энергия превышает энергию активации такого процесса (рис. 5.19).
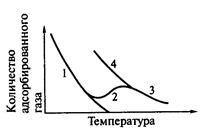
При низких температурах изобара описывает физическую адсорбцию, когда количество адсорбированных молекул, например молекул Н2 на Ni, уменьшается с ростом температуры. При более высоких температурах количество адсорбированных молекул газа увеличивается в связи с началом хемосорбции, однако затем падает. Адсорбция в области 1 обратима, а в области 2 необратима, охлаждение приводит процесс десорбции из области 3 в область 4. Адсорбируемый атом может ионизоваться вследствие обмена зарядом с твердым телом (рис. 5.20).
В терминах зонной теории, если высший заполненный энергетический уровень атома лежит выше уровня Ферми в твердом теле, то электрон может перейти к твердому телу, а адсорбируемый атом становится положительным (рис. 5.20), если же незаполненный уровень адсорбированного атома лежит ниже уровня Ферми, то электрон может перейти к атому, который заряжается отрицательно. Вероятность подобных процессов определяется, естественно, высотой энергетического барьера между атомом и твердым телом. Основной метод изучения адсорбции состоит в установлении зависимости между количеством адсорбируемого газа, температурой и давлением. На рис. 5.21 показана зависимость адсорбируемого газа от давления при постоянной температуре.
Изотерма I — изотерма адсорбции Ленгмюра с насыщением — соответствует образованию мономолекулярного слоя на поверхности. Изотерма II соответствует многослойной адсорбции, она характерна, например, для физической адсорбции. Другие типы изотерм адсорбции встречаются реже. Уравнение изотермы Ленгмюра легко получить, следуя кинетической теории газов. Скорость испарения с частично заполненной поверхности пропорциональна площади поверхности S', покрытой адсорбированными частицами, а скорость конденсации пропорциональна площади свободной поверхности S-S' и числу столкновений газовых молекул с поверхностью в 1 с на 1 см2. Поэтому в условиях равновесия k1 S' =k2 (S - S') (5.12) или S' / S = bp / (1 + bp) (5.13) где b = k2/k1, a k2 и k1 — константы скоростей. Уравнение (5.13) и есть знаменитое уравнение адсорбции Ленгмюра. При низких давлениях количество адсорбируемого газа пропорционально давлению, при высоких давлениях образуется насыщение, что соответствует условию S'/S ≈ 1, т. е. образованию мономолекулярного слоя. Изотерма II — изотерма многослойной адсорбции — представляет интерес главным образом при физической сорбции. Ее обычно называют изотермой БЭТ (Брунауера, Эммета, Теллера). Уравнение это выводится на основе уравнения Ленгмюра, которое применяется к каждому последующему слою. При этом предполагается, что энергия адсорбции (определяющая величину k1) равна теплоте испарения для всех слоев выше первого. В результате получается уравнение v / v m = cx / {(1-x) [1+ (c-1)x]} (5.14) где х = р/р0, р0 — давление насыщенного пара при температуре адсорбции, р — фактическое давление, v / v m — отношение объема адсорбата к объему монослоя v m, с — коэффициент. Это уравнение широко используется для определения площади поверхности по адсорбции инертных газов. Перегиб изотермы адсорбции свидетельствует об образовании мономолекулярного слоя (точка М на рис. 5.21). Зная объем адсорбента, путем простого расчета определяется удельная поверхность. Недостаток модели состоит в том, что в ней не учитывается, что разные участки поверхности (например, плоскости, ребра, углы) могут быть неэквивалентны по отношению к адсорбции. Кроме того, теплоты адсорбции уменьшаются по мере заполнения поверхности, поскольку адсорбция протекает на все менее активных местах. Другие подходы к описанию процесса адсорбции учитывают возможную диссоциацию адсорбированной молекулы на атомы, характерную для катализа. Электронные уровни и молекулярные орбитали (см. рис. 5.3 и 5.4) играют большую роль при характеристике связей адсорбированной молекулы с поверхностью. Для поверхности металлов образуются ковалентные связи с участием частично заполненной d-зоны металла. В процессе хемосорбции молекулы диссоциируют и участвуют в образовании связей уже в виде атомов, что становится возможным, когда энергия связи адсорбированного атома превышает половину энергии диссоциации молекулы адсорбата. Переход из состояния физической сорбции в хемосорбцию можно трактовать на основе диаграммы потенциальной энергии на рис. 5.22. Кривая энергии М + А2 соответствует изменению потенциальной энергии молекулы ai, когда она приближается к поверхности и адсорбируется за счет физической сорбции с малой энергией связи. Аналогичная зависимость М + 2А относится к диссоциативной адсорбции двух атомов А. Неглубокий минимум для физической сорбции отделен от более глубокого минимума для хемосорбции двух атомов потенциальным барьером, который и ограничивает переход из физической сорбции в хемосорбцию.
Примеры адсорбции 1. Адсорбция этилена на поверхности оксидов металлов. Адсорбция этилена на поверхности оксидов происходит весьма быстро и необратимо. Однако теплота адсорбции Q невелика, так, величина Q = 35 кДж/моль на поверхности NiO, на А12Оз • Сr2О3 такая же величина, для ZnO и некоторых цеолитов несколько выше. Такая величина теплоты адсорбции может характеризовать физическую адсорбцию этилена, однако сравнение адсорбции этилена (точка кипения -104° С) и этана (точка кипения -89° С) показало, что при 0° С и давлении 100 Па адсорбция этилена превосходит адсорбцию этана на два порядка величины. Однако в случае физической сорбции адсорбция этана должна была бы превалировать. К тому же теплота конденсации этилена 15 кДж/моль значительно меньше теплоты адсорбции. Тогда делается вывод о том, что адсорбция этилена представляет собой случай хемосорбции, но с образованием слабой связи. Такой связью служит π-связь атомов металла на поверхности с олефином типа С М... | | С что ведет к образованию π -комплекса. Образование π -комплекса было доказано с помощью изменения полос в ИК-спектрах адсорбированных молекул этилена. 2. Адсорбция атомов олова на поверхности силикагелей и цеолитов. Электронное состояние и атомная динамика атомов олова на поверхности силикагелей с размером пор 0, 4, 14 и 27 нм и цеолита М (морденита) исследовалось с помощью мессбауэровской спектроскопии 119Sn. Meccбауэровские спектры представлены на рис. 5.23.
Спектры свидетельствуют о том, что атомы олова сорбируются из раствора в двух формах — SnO2 • nН2О и SnO, причем температурные зависимости нормированной площади под спектром и вероятности f a соответствующие этим двум формам, имеют существенное различие (рис. 5.24). Этот эффект объясняется различным характером сорбции и связи атомов олова с поверхностью.

В то время как ионы Sn2+ связаны с поверхностью глобулы силикагеля в виде SnO за счет хемосорбци SnO2 • nН2О связаны с ней слабыми вандерваальсовыми силами, т. е. находятся в состоянии физической сорбции. Это приводит к более резкой температурной зависимости величины f a для SnO2 • nН2О по сравнению с SnO. Значения f a определяются для этого случая смещением отдельного атома олова и смещением всей молекулы SnO2 • nН2О как целого. При низкой температуре f Sn(4+) определяется колебаниями атома олова в молекуле, а при высокой температуре более существенны колебания самой молекулы (рис. 5.25).
Динамика движения Sn2+ представляет не меньший интерес. На рис. 5.22 отчетливо различается асимметрия интенсивностей линий квадрупольного спектра, которая увеличивается с возрастанием температуры. Эта асимметрия А зависит от анизотропии колебаний атомов Sn2+ на поверхности. В результате расчетов величин
где θ — угол между направлением гамма-квантов и направлением колебаний атомов олова на поверхности и f a, была найдено, что среднеквадратичная амплитуда смещений атомов Sn2+ перпендикулярно поверхности На рис. 5.26 приведена зависимость асимметрии квадрупольного спектра ионов на поверхности (в предположении положительного значения градиента электрического поля) для всех силикагелей и цеолитов, которая соответствует константе g = 0,0045 ± 0,0005 град-1. Величина Для гармонического осциллятора w2 = k/М и g= = k / l2 ×(1 / k1 –1 / k2)
где k1 и k2 — силовые константы в направлениях перпендикулярном и параллельном поверхности. Эти данные позволяют сделать выводы, что, во-первых, двухвалентный ион олова можно рассматривать как гармонический осциллятор и, во-вторых, размер пор не влияет на абсолютные значения ár2ñ. 5.9 Адсорбция молекул воды и атомная динамика атомов железа в пористых ионообменниках. Исследовалась атомная динамика ионов железа, введенных в ионообменные сульфосмолы путем ионного обмена с последующей адсорбцией молекул воды (гидратации). Эти смолы представляют собой сополимеры стирола и дивинилбензола, включающие функциональные (группы) (сульфогруппы), способные к ионному обмену. Они образуют как набухающую, гелевую структуру, так, и ненабухающую структуру с реальной поверхностью в сотни м2/г, так например, КУ-23 имеет удельную поверхность 400 м2/г. Кроме того, размер пор в таких сорбентах можно менять, варьируя степень сшивки стирола дивинилбензолом. Гидратация смолы приводит к падению интенсивности мессбауэровских спектров 57Fe, причем величина /„ линейно зависит от числа молекул адсорбированной воды (рис. 5.27). Величина f a полностью исчезает одновременно для Fe3+ и Fe2+ при весьма малой степени гидратации, одинаковой для набухающей (КУ-2) и ненабухающей смол и составляющей 4 молекулы Н2О на один обменный катион (что составляет 0,04 ¸ 0,16 от максимального количества воды в этих смолах). Уменьшение f a связано с возрастанием величин ár2ñ для катионов железа в порах после адсорбции воды.
После замораживания сорбентов до 77 К наблюдаются интенсивные мессбауэровские спектры как в гидратированных, так и в негидратированных смолах. Повышение температуры от 77 до 300 К в негидратирован-ных смолах приводит лишь к незначительному уменьшению величины f a и не зависит от степени сшивки. В полностью гидратированной смоле (рис. 5.28) величина f a резко уменьшается, начиная с 170 К, исчезает при 250 К и зависит от степени сшивки. Если при гидратации обменные ионы равномерно распределяются по всему объему жидкой фазы внутри смолы, концентрация их увеличивается с повышением степени сшивки и составляет для данных систем 0,63; 1,0 и 2,3 г-ион/л при степенях сшивки 1, 7 и 12%. В этом случае большей степени сшивки должна, казалось бы, соответствовать более низкая температура плавления замороженной жидкости в порах и, следовательно, более низкая температура исчезновения эффекта. Однако опыт дает противоположный результат. Из этого следует, что в действительности в набухающей сульфосмоле гидратированные обменные ионы железа не распределены равномерно по всему объему жидкой среды, а концентрируются около обменных центров. Очевидно, что именно в этом случае различия в температуре исчезновения эффекта определяются структурой полимерной сетки, а не суммарной концентрацией в фазе воды: чем более открытой является структура смолы, тем более подвижны ионы и тем ниже температура исчезновения f a.Таким образом, характер увеличения ár2ñ после адсорбции воды зависит от степени сшивки полимерной структуры смолы.
  Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам...  Что будет с Землей, если ось ее сместится на 6666 км? Что будет с Землей? - задался я вопросом...  Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.)...  ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры... Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|