|
Методика расчетов энергетических характеристик порохов и РТТ
Методика расчетов энергетических характеристик порохов и РТТ
Основными энергетическими характеристиками порохов и РТТ (далее – композиций) являются:
QW(ж) – теплота взрывчатого превращения (теплота горения, калорийность) при постоянном объеме и воде – жидкости, кДж/кг;
QW(n) – теплота взрывчатого превращения при постоянном объеме и воде – паре, кДж/кг;
TГ – температура продуктов горения, К;
Wi – удельный объем газообразных продуктов горения, м3/кг;
f – сила, кДж/кг.
Qw(ж) и Qw(n),которые связаны между собой следующим выражением:
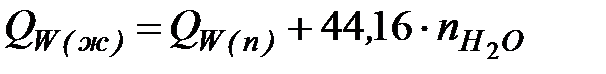 , кДж, , кДж,
| (4.1)
|
где 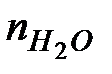 – количество молей воды в продуктах горения 1кг, композиции; – количество молей воды в продуктах горения 1кг, композиции;
44,16 - количество тепла, кДж, выделяющегося при конденсации одного моля воды.
Тепловые эффекты, приводимые в реакциях горения, чаще всего предполагают, что вода – жидкая, однако при расчете ТГ следует использовать QW(n), так как вода при температуре горения находится в парообразном состоянии.
Расчет энергетических характеристик можно проводить различными методами. Точность этих методов зависит главным образом от того, какие реакции, протекающие при горении, учитываются, и какие исключаются как второстепенные, а также от точности выбранных значений теплоёмкости продуктов горения и принятых значений теплот образования исходных компонентов композиции.
В практике расчета энергетических характеристик композиций широко применяются два метода: основной и упрощенный.
Основной метод расчета энергетических характеристик
Основной метод расчета энергетических характеристик композиции основан на предположении, что процесс горения является адиабатическим, протекает при постоянном объеме, а выделяющееся тепло тратится только на нагрев продуктов горения и не теряется в окружающую среду. Такое предположение несколько не соответствует действительному процессу взрывчатого превращения композиций, так как в последнем случае тепло частично тратится на нагрев стенок. Кроме того, горение композиций происходит в переменном объеме.
Однако, принятые выше допущения, позволяют использовать для расчета закон сохранения энергии, закон сохранения вещества и уравнения для констант равновесий реакций, что оказывается достаточным для решения задачи по определению состава и температуры продуктов горения.
При расчете по основному методу считается, что при горении пороха содержащего углерод, водород, кислород и азот, образуются следующие продукты горения: СО2, СО, Н2О, Н2, N2, причем соотношения первых четырех компонентов продуктов горения определяются уравнением для константы равновесия реакции водяного газа
 , ,
| (4.2)
|
где ni - число молей соответствующего компонента продуктов горения.
Такое предположение допустимо ввиду того, что горение композиции происходит при высоких давлениях, когда реакции термической диссоциации продуктов горения практически отсутствуют.
Таким образом, исходным данными для расчета являются:
- условная формула 1 кг композиции необходимая для составления и решения уравнений материального баланса;
- теплота образования, используемая для составления уравнения, отражающего закон сохранения энергии.
Расчет энергетических характеристик по основному методу состоит из следующих этапов:
- расчет условной формулы 1кг композиции;
- расчет теплоты образования 1кг композиции;
- расчет состава продуктов горения при произвольно выбранной температуре горения;
- проверка правильности выбранной температуры;
- расчет удельного объема газообразных продуктов горения коволюма и силы композиции.
Приложение 1
Условные формулы и энтапльпии образования 1кг нитроцеллюлозы в зависимости от содержания азота
| Содержание
азота, %
(по массе)
| Число-грамм-атомов на 1 кг *
| ∆Hобр ., кДж/кг **
| | С
| Н
| О
| N
| |
|
|
|
|
|
| | 11,50
| 23,334
| 30,631
| 35,864
| 8,210
| – 2989
| | 11,60
| 23,215
| 30,411
| 35,908
| 8,281
| – 2964
| | 11,70
| 23,096
| 30,142
| 35,962
| 8,352
| – 2938
| | 11,80
| 22,978
| 29,872
| 35,995
| 8,424
| – 2912
| | 11,90
| 22,859
| 29,603
| 36,039
| 8,495
| – 2887
| | 12,00
| 22,740
| 29,333
| 36,083
| 8,567
| – 2861
| | 12,10
| 22,621
| 29,064
| 36,127
| 8,638
| – 2835
| | 12,20
| 22,502
| 28,794
| 36,170
| 8,709
| – 2810
| | 12,30
| 22,383
| 28,525
| 36,214
| 8,781
| – 2784
| | 12,40
| 22,264
| 28,255
| 36,258
| 8,852
| – 2759
| | 12,50
| 22,145
| 27,985
| 36,301
| 8,923
| – 2733
| | 12,60
| 22,026
| 27,716
| 36,345
| 8,995
| – 2707
| | 12,70
| 21,908
| 27,447
| 36,389
| 9,066
| – 2682
| | 12,80
| 21,788
| 27,177
| 36,433
| 9,138
| – 2656
| | 12,90
| 21,670
| 26,908
| 36,476
| 9,209
| – 2630
| | 13,00
| 21,551
| 26,638
| 36,520
| 9,280
| – 2605
| | 13,10
| 21,432
| 26,369
| 36,564
| 9,352
| – 2579
| | 13,20
| 21,313
| 26,099
| 36,607
| 9,423
| – 2554
| | 13,30
| 21,149
| 25,829
| 36,651
| 9,495
| – 2528
| | 13,40
| 21,075
| 25,560
| 36,695
| 9,566
| – 2502
| | 13,50
| 20,957
| 25,290
| 36,739
| 9,637
| – 2476
| | 13,60
| 20,838
| 25,021
| 36,782
| 9,709
| – 2451
| | 13,70
| 20,719
| 24,751
| 36,826
| 9,780
| – 2425
| | 13,80
| 20,600
| 24,482
| 36,870
| 9,852
| – 2400
| | 13,90
| 20,481
| 24,212
| 36,913
| 9,923
| – 2374
| | 14,00
| 20,362
| 23,943
| 36,957
| 9,994
| – 2348
| | 14,10
| 20,243
| 23,673
| 37,001
| 10,066
| – 2323
| * Числа грамм-атомов элементов в условной формуле 1 кг нитрата целлюлозы могут быть рассчитаны по следующим формулам:
С = 37,005 – 1,1887×N%; H = 61,6751–2,0952×N%; O = 30,8375 + 0,4371×N%;
N = 0,7138* N%, где N%- содержание азота в нитрате целлюлозы в процентах по массе.
** Энтальпию образования нитратов целлюлозы можно рассчитать по следующей формуле: ∆Hобр.=256,287× N% – 5936 (кДж/кг)
Приложение 2
Значение βi, W i и ∆Нобр.i некоторых компонентов композиций
| Компонент
| Брутто-формула
| β, кДж/%
| Wi ×10-3, м3/%
| ∆Нобр, кДж/кг
| | Нитрат целлюлозы
| -
| -
| (15,35 – 0,5× N%)
| -
| | Нитроглицерин
| C3H5O9N3
| +74,1
| 6,91
| – 1547
| | Нитродигликоль
| C4H8O7N2
| +45,2
| 10,28
| – 222,4
| | Гексоген
| C3H6O6N6
| +58,2
| 9,08
| + 294,8
| | Октоген
| C4H8O8N8
| +52,1
| 9,08
| + 241,8
| | Нитрогуанидин
| CH4O2N4
| +28,1
| 10,76
| – 879,0
| | Динитротолуол
| C7H6O4N2
| +4,2
| 13,54
| – 356,3
| | Централит №1
| C17H20ON2
| -103,8
| 23,39
| – 394,6
| | Централит №2
| C15H16ON2
| -99,6
| 22,40
| – 150,5
| | Дифениламин
| C12H11N
| -113,5
| 23,85
| + 697,5
| | Дибутилфталат
| C16H22O4
| -88,3
| 21,76
| – 3117,0
| | Вазелин
| C15H32
| -139,4
| 32,75
| – 1437,2
| | Окись магния
| MgO
|
|
| – 15062,5
| | Камфора
| C10H16O
| -112,2
| 26,53
| – 2117,7
| | Спирт этиловый
| C2H6O
| -71,2
| 24,34
| – 6096
| | Эфир этиловый
| C4H10O
| -93,8
| 27,24
| – 3259,4
|
β = 5,43× N%– 28 (кДж/%);
∆Hобр .=256,287×N – 5936 (кДж/кг), где N% – содержание азота в %.
Приложение 3
Термохимические поправки Δi для расчета теплот сгорания QР сг органических веществ по Карашу
| № п.п.
| Группировки и связи
| Структура
| Δi, кДж/моль
| |
| Фторалканы
| Alk–F
| -117
| |
| Сульфогруппа в ароматических углеродах
| Ar–SO3H
| -98
| |
| Связь конденсированных ароматических ядер
|
| -84
| |
| Нитраты аминов
| R3NH+ NO3–
| -67,4
| |
| Нитрогруппа в алифатических и ароматических соединениях
| R–NO2
| -54,4
| |
| Нитрогруппа в геминальных динитросоединениях
| R–CH(NO2)2
| -41,8
| |
| Карбоксильная группа в ароматических соединениях
| Ar–COOH
| -54,4
| |
| Связь ароматических радикалов:
|
|
| | 8а
| Ароматический радикал с ацетиленовым радикалом
| Ar–C≡C–
| -27,2
| | 8б
| Ароматический радикал с виниловым радикалом
| 
| -27,2
| | 8в
| Ароматический радикал и нитрил
| Ar–C≡N
| -27,2
| | 8г
| Ароматический радикал и азот
| Ar–N=
| -14,6
| |
| Нитрогруппа в тринитрометильных соединениях
| Alk–C(NO2)3
| -27,2
| |
| Группа мочевины
| 
| -29,3
| |
| Ароматический и алифатический радикалы
| Ar–Alk
| -14,6
| |
| Четвертичный углеродный атом
| 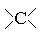
| -14,6
| |
| Карбоксильная группа в кислотах
| R–COOH
|
| |
| Нитраты спиртов
| Alk–O–NO2
|
| |
| Нитрогруппа в тетранитрометане
| C(NO2)4
|
| |
| Спирты третичные
| (R)3C–OH
| +14,6
| |
| Фенолы
| Ar–OH
| +14,6
| |
| Алканы
| –CH2–CH2–
| +22,2
| |
| Нитроамины первичные
| R–NH–NO2
| +27,2
| |
| Спирты вторичные
| (R)2CH–OH
| +27,2
| |
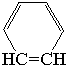
| Этиленовая связь в кольце
| 
| +27,2
| |
| Кетоны алифатические и ароматические
| (R)2C=O
| +27,2
| |
| Амины ароматические первичные
| Ar–NH2
| +27,2
| |
| Замещенные амиды
| 
| +27,2
| |
| Ароматический радикал и хлор
| Ar‑Hal
| +27,2
| |
| Оксикислоты типа
| 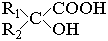
| +27,2
| |
| Сложные эфиры ароматических кислот
| Ar–COO–Ar′
| +41,8
| |
| Ангидриды карбоновых кислот
| 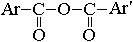
| +41,8
| |
| Нитриты
| R–ONO
| +41,8
| |
| Спирты первичные
| R–OH
| +54,4
| |
| Нитрамин вторичный
| 
| +54,4
| |
| Нитрилы
| R–C≡N
| +54,4
| |
| Этиленовая связь
| >C=C<
| +54,4
| |
| Альдегиды алифатические и ароматические
| R–CHO
| +54,4
| |
| Амины алифатические первичные
| Alk–NH2
| +54,4
| |
| Алифатический радикал и хлор
| Alk–Hal
| +54,4
| |
| Эфиры алифатические сложные
| R–COOR
| +69,0
| |
| Нитрозоамин
| >N–NO
| +69,0
| |
| Гидразиновая связь
| >N–N<
| +69,0
| |
| Эфиры простые
| R1–O–R2
| +81,6
| |
| Амины алифатические вторичные
| (Alk)2NH
| +81,6
| |
| Амины ароматические третичные
| (Ar)3N
| +81,6
| |
| С-нитрозосоединения
| ≡C–NO
| +83,7
| |
| Амины алифатические третичные
| (Alk)3N
| +108,8
| |
| Оксимы
| >C=NOH
| +108,8
| |
| Ацетиленовая связь (полностью замещенная)
| R–C≡C–R′
| +138,5
| |
| Ацетиленовая связь
| H–C≡C–R
| +193,0
| |
| Ароматические глиоксимы
| HON=Ar=NOH
| +167,8
| |
| Тетразолы
| 
| +268,0
| |
| Азосоединения
| R–N=N–R
| +268,0
| |
| Азиды
| –N=N≡N
| +293,0
|
Приложение 4
Средние теплоемкости продуктов горения при постоянном объеме
В интервале температур от 293 до Т К
| Соединения
| Средняя теплоемкость при постоянном объеме 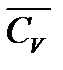 , Дж/(моль×град),
в интервале температур от 293 К до Т, К , Дж/(моль×град),
в интервале температур от 293 К до Т, К
| Соединения
| | температуры Т, К
| |
|
|
|
|
|
|
|
|
|
| | СО2
| 40,11
| 40,95
| 41,66
| 42,37
| 43,00
| 43,54
| 44,04
| 44,55
| 45,01
| 45,38
| СО2
| | H2O
| 29,39
| 30,02
| 30,60
| 31,23
| 31,86
| 32,45
| 32,99
| 33,58
| 34,12
| 34,62
| H2O
| | CO
| 22,90
| 23,19
| 23,49
| 23,74
| 23,99
| 24,24
| 24,24
| 24,66
| 24,83
| 25,04
| CO
| | H2
| 21,31
| 21,44
| 21,56
| 21,73
| 21,90
| 22,06
| 22,27
| 22,44
| 22,61
| 22,78
| H2
| | N2
| 22,57
| 22,86
| 23,11
| 23,40
| 23,66
| 23,96
| 24,07
| 24,28
| 24,49
| 24,66
| N2
| | O2
| 24,57
| 24,66
| 24,95
| 25,20
| 25,46
| 25,66
| 25,92
| 26,08
| 26,29
| 26,46
| O2
| | CH4
| 48,36
| 50,66
| 52,75
| 54,76
| 56,60
| 58,36
| 59,95
| 61,50
| 62,88
| 64,22
| CH4
| | NO
| 23,66
| 23,95
| 24,20
| 24,45
| 24,70
| 24,91
| 25,12
| 25,29
| 25,46
| 25,62
| NO
| |
| |
| температуры Т, К
|
| |
|
|
|
|
|
|
|
|
|
| | СО2
| 45,76
| 46,10
| 36,43
| 46,77
| 47,06
| 47,31
| 47,56
| 47,81
| 48,02
| 48,27
| СО2
| | H2O
| 35,18
| 35,63
| 36,09
| 36,55
| 36,97
| 37,39
| 37,81
| 37,22
| 38,60
| 38,98
| H2O
| | CO
| 25,16
| 25,33
| 25,50
| 25,62
| 25,75
| 25,87
| 26,00
| 26,09
| 26,20
| 26,29
| CO
| | H2
| 22,98
| 23,19
| 23,36
| 23,53
| 23,70
| 23,86
| 24,03
| 24,20
| 24,37
| 24,53
| H2
| | N2
| 24,83
| 25,00
| 25,16
| 25,29
| 25,41
| 25,54
| 25,66
| 25,79
| 25,92
| 26,00
| N2
| | O2
| 26,63
| 26,80
| 26,96
| 27,13
| 27,26
| 27,42
| 27,59
| 27,72
| 27,84
| 28,01
| O2
| | CH4
| 65,48
| 66,61
| 67,74
| 68,79
| 69,75
| 70,67
| 71,51
| 72,35
| 73,10
| 73,86
| CH4
| | NO
| 25,79
| 25,92
| 26,04
| 29,17
| 26,29
| 26,38
| 26,50
| 26,59
| 26,67
| 26,75
| NO
| |
| температуры Т, К
|
| |
|
|
|
|
|
|
|
|
|
| | СО2
| 48,44
| 48,65
| 48,86
| 49,03
| 49,15
| 49,36
| 49,49
| 49,65
| 49,78
| 49,95
| СО2
| | H2O
| 39,31
| 39,69
| 40,02
| 40,32
| 40,65
| 40,95
| 41,24
| 41,53
| 41,83
| 42,12
| H2O
| | CO
| 26,42
| 26,50
| 26,59
| 26,67
| 26,73
| 26,80
| 26,88
| 26,96
| 27,02
| 27,09
| CO
| | H2
| 24,70
| 24,83
| 25,00
| 25,12
| 25,29
| 25,41
| 25,54
| 25,70
| 25,83
| 25,96
| H2
| | N2
| 26,12
| 26,21
| 26,29
| 26,38
| 26,46
| 26,54
| 26,62
| 26,67
| 26,75
| 26,84
| N2
| | O2
| 28,14
| 28,26
| 28,37
| 28,51
| 28,64
| 28,76
| 28,89
| 29,01
| 29,10
| 29,22
| O2
| | CH4
| 74,52
| 75,19
| 75,82
| 76,41
| 76,99
| 77,54
| 78,04
| 78,54
| 79,00
| 79,46
| CH4
| | NO
| 26,84
| 26,92
| 27,00
| 37,05
| 27,13
| 27,18
| 27,26
| 27,31
| 27,38
| 27,42
| NO
| |
| температуры Т, К
|
| |
|
|
|
|
|
|
|
|
|
| | СО2
| 50,07
| 50,20
| 50,32
| 50,45
| 50,58
| 50,66
| 50,78
| 50,91
| 51,00
| 51,03
| СО2
| | H2O
| 42,37
| 42,66
| 42,91
| 43,16
| 43,42
| 43,67
| 43,92
| 44,13
| 44,38
| 44,59
| H2O
| | CO
| 27,13
| 27,21
| 27,26
| 27,31
| 27,37
| 27,42
| 27,46
| 27,51
| 27,55
| 27,60
| CO
| | H2
| 26,08
| 26,21
| 26,33
| 26,46
| 26,58
| 26,71
| 26,84
| 26,92
| 27,05
| 27,17
| H2
| | N2
| 26,88
| 26,94
| 27,00
| 27,05
| 27,13
| 27,17
| 27,21
| 27,26
| 27,33
| 27,38
| N2
| | O2
| 29,35
| 29,43
| 29,55
| 29,64
| 29,73
| 29,85
| 29,94
| 30,02
| 30,14
| 30,23
| O2
| | CH4
| 79,88
| 80,30
| 80,72
| 81,10
| 81,48
| 81,81
| 82,19
| 82,52
| 82,81
| 83,11
| CH4
| | NO
| 27,46
| 27,52
| 27,58
| 27,63
| 27,67
| 27,72
| 27,76
| 27,80
| 27,84
| 27,88
| NO
|
Приложение 5
Значения константы равновесия реакции водяного газа
при различных температурах.
| Т, К
| КВ.Г.
| Т, К
| КВ.Г.
| Т, К
| КВ.Г.
| |
| 0,732×10-2
|
| 4,989
|
| 8,676
| |
| 0,355×10-1
|
| 5,332
|
| 8,807
| |
| 0,107
|
| 5,656
|
| 8,928
| |
| 0,238
|
| 5,968
|
| 9,048
| |
| 0,437
|
| 6,261
|
| 9,156
| |
| 0,701
|
| 6,538
|
| 9,273
| |
| 1,020
|
| 6,799
|
| 9,351
| |
| 1,383
|
| 7,045
|
| 9,447
| |
| 1,775
|
| 7,274
|
| 9,532
| | 1400.
| 2,188
|
| 7,489
|
| 9,612
| |
| 2,608
|
| 7,692
|
| 9,684
| |
| 3,032
|
| 7,886
|
| 9,756
| |
| 3,446
|
| 8,067
|
| 9,818
| |
| 3,853
|
| 8,230
|
| 9,886
| |
| 4,244
|
| 8,390
| -
| -
| |
| 4,625
|
| 8,540
| -
| -
|
Методика расчетов энергетических характеристик порохов и РТТ
Основными энергетическими характеристиками порохов и РТТ (далее – композиций) являются:
QW(ж) – теплота взрывчатого превращения (теплота горения, калорийность) при постоянном объеме и воде – жидкости, кДж/кг;
QW(n) – теплота взрывчатого превращения при постоянном объеме и воде – паре, кДж/кг;
TГ – температура продуктов горения, К;
Wi – удельный объем газообразных продуктов горения, м3/кг;
f – сила, кДж/кг.
Qw(ж) и Qw(n),которые связаны между собой следующим выражением:
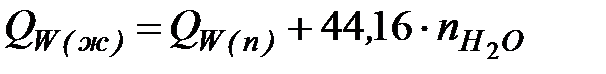 , кДж, , кДж,
| (4.1)
|
где 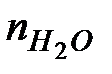 – количество молей воды в продуктах горения 1кг, композиции; – количество молей воды в продуктах горения 1кг, композиции;
44,16 - количество тепла, кДж, выделяющегося при конденсации одного моля воды.
Тепловые эффекты, приводимые в реакциях горения, чаще всего предполагают, что вода – жидкая, однако при расчете ТГ следует использовать QW(n), так как вода при температуре горения находится в парообразном состоянии.
Расчет энергетических характеристик можно проводить различными методами. Точность этих методов зависит главным образом от того, какие реакции, протекающие при горении, учитываются, и какие исключаются как второстепенные, а также от точности выбранных значений теплоёмкости продуктов горения и принятых значений теплот образования исходных компонентов композиции.
В практике расчета энергетических характеристик композиций широко применяются два метода: основной и упрощенный.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|




