|
|
Равновесие химико-технологических процессов.Стр 1 из 5Следующая ⇒ Лекция №1 Введение Химическая технология – это наука об экономически и экологически обоснованных методах переработки сырья в средства производства и предметы потребления. Химическая технология состоит из двух основных блоков: 1) Изучение теоретических основ протекания химико-технологических процессов на молекулярно-кинетическом уровне. Этот блок включает изучение законов термодинамики и кинетики. 2) Теоретические основы функционирования химического реактора. Первое приближение к физхимии, второе к процессам и аппаратам. Основная задача нашего курса: получение навыков и решения двух задач: 1) Задача проектирования химического реактора. Суть задачи: при известных значениях управляющих параметров необходимо рассчитать объем реактора, который обеспечивает требуемые показатели интенсивности работы реактора. 2) Задача моделирования реактора. Суть задачи: при известном объеме реактора исследуется влияние управляющих параметров на величину показателей интенсивности работы реактора. Любой химко-технологический процесс состоит как минимум из 3 стадий: 1 стадия – подвод реагентов к поверхности контакта (раздела) фаз или в объем другой фазы. 2 стадия – непосредственное химическое превращение. 3 стадия – отвод продуктов от поверхности раздела фаз или из объема другой фазы. Каждая из стадий протекает со своей скоростью, но определяющей является стадия, протекающая с наименьшей скоростью, и все остальные стадии подстраиваются под самую медленную. Соответственно, стадия процесса, обладающая наименьшей скоростью, называется лимитирующей стадией. Если скорость первой или третей стадии меньше, чем скорость второй, то процесс протекает в диффузионной области и в качестве управляющих выступают макрокинетические параметры, к которым относятся: 1)линейная скорость подачи реагентов. 2)степень перемешивания реагентов. 3)размеров единичных элементов, принимаемых участие в процессы
 
где U – скорость диффузии; D – скорость диффузии, так он зависит от температуры, температура будет влиять слабо (если E мала), z – концентрация компонента. Независимо от того, какая реакция, скорость будет пропорциональна концентрации в первой степени. Если скорость второй стали меньше, чем скорость первой и третей стали, то процесс протекает в кинетической области и управляющими являются микрокинетические параметры: температура, давление, концентрация участников процесса. Температура влияет в соответствии с уравнением Аррениуса:
где EА - энергия активации реакции,[Дж/моль]; R=8,31 Дж/моль∙К Энергия активации – минимальный избыток энергии, который необходимо сообщить реагирующей системе, чтобы произошел элементарный акт химической реакции где Т – температура в абсолютной шкале Кельвин. k0 – предэкспоненциальный множитель. Давление Концентрации Рассмотрим реакцию: aA + bB = cC +dD Реакция является формально простой, т.е. химическая реакция протекает в один этап. U=k[A]a [B]b где a, b - степени молекулярности по компоненту. Концентрация – отношение конкретного количества вещества к суммарному количеству вещества. Мольная доля – отношение числа молей компонента к суммарному числу молей компонентов в смеси. Моль – количество вещества, содержащее такое же число структурных единиц, которые содержатся в 12 г изотопа С12. Объемная доля – отношение объема данного вещества к суммарному объему вещества. Величина используется в основном для газов. Обычно используется в системах жидкость – жидкости газофазных процессах. Массовая доля – отношение массы компонента к суммарной массе. Обычно используется для процессов с участием твердой фазы, технически реализовать проще. Для газов объемные и массовые доли совпадают.
Лекция №2 Степень превращения – отношение количества вещества, вступившего в реакцию к начальному количеству вещества. В том случае, если исходные реагенты находятся в стехиометрическом соотношении, степени превращения по реагентам совпадают.
В подавляющем большинстве случаев реагенты подаются в нестехиометрическом соотношении, поэтому практическую ценность имеет степень превращения вещества, находящегося в недостатке. Выход продукта – отношение производительности по продукту к максимально возможной производительности по рассматриваемому веществу. В принципе, выход по продукту численно совпадает со степенью превращения ключевого компонента. Степень превращения обозначается Х, а выход продукта – f с подстрочным индексом, указывающим на вещество, по которому взят это показатель.
Расходный коэффициент – это количество исходного реагента, которое необходимо для производства единицы количества продукта. Различают теоретический расходный коэффициент, который рассчитывается на основании стехиометрического уравнения и практический расходный коэффициент, который учитывает чистоту сырья и степень превращения сырья. Теоретический расходный коэффициент рассчитывается:
Для технических расчетов принимаем, что газы SO2 и SO3 идеальны, то 1 кмоль занимает объем 44.8 м3. Таким образом, отношение заменяют отношением молярных масс.
Селективность – величина, которая используется в том случае, если в реакторе могут протекать одновременно 2 и более реакции. Интегральная селективность – это отношение производительности по ключевому компоненту в целевой реакции к суммарной производительности по ключевому компоненту по всем реакциям, протекающим в реакционном объеме. Величина интегральной селективности может меняться от 0 до 1. Если интегральная селективность равна единице, то все побочные реакции заблокированы. Если она равна нулю, то не протекает целевая реакция. I. 4NH3+5O2=4NO+6H2O II. 4NH3+3O2=2N2+6H2O Система в упрощенном виде для процесса окисления NH3 в производстве азотной кислоты. Очевидно, что I реакция является целевой, поскольку получается оксид азота, который в дальнейшем превращается в диоксид и адсорбируется с образованием азотной кислоты. II реакция – побочная, так как с трудом полученный аммиак расходуется на производство азота, который используется при синтезе аммиака. Здесь селективность – это производительность по NH3 I реакции, отнесенная к производительности по NH3 в I реакции и производительности по NH3 во II реакции: Селективность
В производстве азотной кислоты считается приемлемым, если селективность получается в порядке 0.94. Такая селективность достигается двумя путями: 1) Использование селективных катализаторов. В настоящее время в реакторах окисления SO2 используют два катализатора. 1 секция – стандартные традиционные катализаторы в виде платиновых сеток. 2 секция - блочные катализаторы ИК42, активный компонент-железо.
2) Увеличив концентрацию О2 мы увеличим производительность по первой реакции, но уменьшим концентрацию NH3. Поэтому надо искать оптимальную концентрацию О2. Дифференциальная селективность – отношение скорости целевой реакции к сумме скоростей всех реакций, протекающих в реакционном объеме. Меняется в интервале от 0 до 1 и обозначается Производительность – изменение количества вещества в единицу времени. Производительность по веществу – разность между конечным и начальным количеством вещества. Лекция №3 Кинетика химических реакций Рассмотрим реакцию: aA + bB = cC +dD
где Скорость численно равна изменению числа молей ключевого реагента в единицу времени в единице реакционного объёма.
Таким образом, скорость позволяет определить время химической реакции. Скорость химической реакции пропорциональна движущей силе химической реакции
Формальная кинетика основывается на том, что скорость пропорциональна концентрации, а показатели будут являться коэффициентами. В истинной кинетике считается, что любая химическая реакция многостадийна. Например, 1. 2. 3. …………………….. и т.д. Просуммировав все стадии, придём к исходному уравнению. Самая медленная стадия первая, поэтому она и определяет скорость химической реакции. Истинная кинетика определяет механизм реакции, и уравнения истинной кинетики отличаются от уравнений формальной. Формальная кинетика: Истинная кинетика: Зависимость
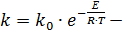 уравнениеАррениуса; уравнениеАррениуса; 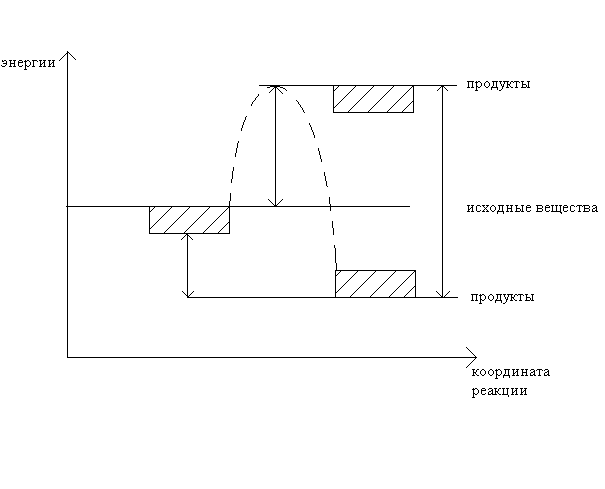
где где [AB*] Е
Если Е2 > Е1 , то реакция экзотермическая, а если Е2 < Е1, то реакция эндотермическая. Кинетическое уравнение имеет параметры: Е,
Обратимые реакции
где
где ДС Выразим
Константу равновесия можно выразить через энергию Гиббса:
Рассмотрим случаи:
1.1. Если
Причина увеличения скорости для эндотермической реакции: движущая силы увеличивается, константа скорости химической реакции также увеличивается.
1.2. Если
Для экзотермической реакции: скорость увеличивается, так как с ростом температуры возрастание константы скорости опережает снижение движущей силы. Затем скорость уменьшается, так как преобладает снижение движущей силы. Этим объясняется наличие экстремума. 2. Т и XA = const
При увеличении давления возрастает величина Рa+b, следовательно увеличивается скорость реакции. С увеличением давления движущая сила химической реакции уменьшается, скорость реакции уменьшается.
В этом случае скорость увеличивается, т.к увеличивается движущая сила
Скорость увеличивается, так как возрастает величина Рa+b. Таким образом, с увеличением давления скорость реакции всегда увеличивается. 3. Т и XA = const
С увеличением степени превращения скорость реакции уменьшается, так как уменьшается движущая сила (или уменьшается концентрация реагента). При достижении равновесия скорость равна 0.
Лекция №4 Лекция №5 В основе метанольных топливных элементов лежит реакция: СН3ОН = СО + 2Н2
CO тормозит реакцию, так как находится в адсорбированном состоянии на катализаторе и неохотно его покидает. Это уравнение каталитической реакции. Проанализируем, как будет зависеть скорость процесса от давления, при Т=const и ХСН3ОН=const. Для этого применим закон Дальтона:
Получаем, что скорость прямой реакции не зависит от давления, а скорость обратной реакции зависит от давления линейно.
Вычитая из U, U получаем, что для этой реакции наблюдаемая скорость уменьшается с ростом давления. Таким образом, для данной реакции отсутствует понятие Ропт, а любое увеличение давления, выше атмосферного, приведет к снижению скорости. Отталкиваться нужно от Ратм. Задачи
1. Р, ННСl=const 2. Р
Экзотермическая реакция 1. T, P = const 2. T 3. P
Лекция №6 Лекция №7 Реакторы Любой реактор можно приблизить к идеализированной модели. Проведя расчёт по идеализированной системе, мы можем выбрать либо реактор идеального вытеснения (РИВ), либо реактор полного смешения (РПС). Таким образом, взамен уравнений гидродинамики разработаны две идеализированные модели. Лекция №8 Рассмотрим модельную реакцию. aA + bB = cC + dD, при условии, что температура, давление, начальные мольные доли компонентов и расход смеси постоянны. Рассмотрим реактор полного смешения, работающий в изотермическом режиме.
Vp=(VNS*ZNA/22.4*10-3)/(XКА/U) Допустим, что объём реактора может меняться от нуля до бесконечно большой величины. На первом этапе определим, каковы будут показатели интенсивности реактора при объёме реактора, равном нулю и объёме реактора, стремящемся к бесконечности. При объёме реактора, равном нулю, скорость будет иметь некоторое значение, отличное от нуля, степень превращения будет равна нулю, производительность по продукту равна нулю, мольная доля продукт численно равна начальной мольной доле. При объёме реактора, стремящемуся к бесконечности, процесс будет приближаться к состоянию равновесия. Скорость близка к нулю, но нуля не достигает. Степень превращения будет стремиться к равновесному значению. Производительность по компоненту С будет стремиться к некоторому предельному значению, которое определяется расходом реакционной смеси, начальной мольной долей компонентов и максимально возможной степенью превращения ключевого компонента. При постоянном значении температуры и давления и начальных мольных долей реагентов на величину скорости будет оказывать влияние только изменение текущих мольных долей реагентов. Независимо от того, насколько интенсивно протекает реакция, по мере её протекания мольные доли исходных реагентов уменьшаются, а мольные доли продуктов увеличиваются. Следовательно, наблюдаемая скорость реакции будет уменьшаться во всём диапазоне изменения объёма реактора. Мы определили форму зависимости скорости и можем сказать, что форма остальных зависимостей – это выпуклая кривая. Важно, что нет никаких точек перегиба. Для реальной оценки реактора надо принимать во внимание насколько изменится степень превращения при увеличении объёма реактора. Лекция №9 Лекция №10 Лекция №11 Задачи. 1)

В первом реакторе объем первой фазы должен быть больше, чем последующей.
2)
3) Вид зависимости степени превращения от доли байпаса
Скорость увеличивается, так как степень превращения увеличивается. Затем она падает. Лекция № 11 Гетерогенные процессы. К гетерогенным процессам относятся процессы в системах: газ – твёрдое вещество, газ – жидкость, жидкость – твёрдое вещество, твёрдое – твёрдое, жидкость – жидкость (если жидкости несмешивающиеся), газофазные процессы при участии твёрдых катализаторов. Отличительной особенностью любого гетерогенного процесса является наличие поверхности раздела фаз, которая может быть постоянной, либо меняться во времени. При протекании гетегогенного процесса наряду с чисто химическими стадиями существуют диффузионные стадии. Поэтому для управления гетерогенным процессом важна идентификация лимитирующей стадии. В общем случае для идентификации лимитирующей стадии исследуют зависимость скорости реакции от температуры, и на этой зависимости можно выделить три области:
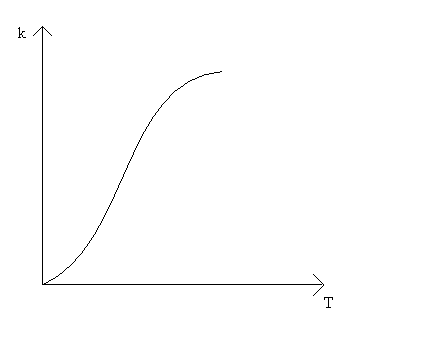
1 – скорость возрастает с увеличением температуры, и выполняется закон Аррениуса. Это кинетическая область протекания процесса. Управляющими будут микрокинетические факторы (температура, давление, концентрации). 3 – скорость процесса практически не зависит от температуры. Диффузионная область энергии активации и диффузии очень мала, следовательно, изменение температуры не приводит к изменению коэффициента диффузии, и скорость изменяется несущественно. Управляющими являются макрокинетическими параметры, связанные со скоростью подачи реагентов, степенью перемешивания реагентов, степенью диспергирования реагентов. Также в этой области в соответствии со скоростью диффузии по первому закону Фика управляющей является концентрация реагентов: 2 – переходная область. Скорость увеличивается с увеличением температуры, но закон Аррениуса не выполняется. В этой области управляющими являются и микро-, и макрокинетические факторы, но интенсивность их воздействия на процесс меньше, чем в соответствующей области протекания. С точки зрения промышленной реализации область 2 наименее перспективна, но следует учитывать, что по ходу гетерогенного процесса он может переходить из одной области в другую. Поэтому для предотвращения перехода изменение одного из микрокинетических параметров обычно сопровождают изменением какого-либо макрокинетического параметра. Гетерогенный процесс – это процесс многостадийный. Наиболее простыми являются процессы в системе жидкость – газ, которые обычно протекают в три стадии: 1-я стадия: область внешней диффузии, то есть подвод газа и жидкости к поверхности раздела фаз, которая чаще всего формируется искусственно (насадочная колонна). 2-я стадия: химическое взаимодействие. Кинетическая область. 3-я стадия: отвод продуктов от поверхности раздела фаз. Внешняя диффузионная область протекания процесса. В подавляющем большинстве случаев процессы в системе жидкость – газ протекают во внешней диффузионной область, поэтому при проектировании оборудования необходимо решать проблему одновременного увеличения линейной скорости подачи реагентов и увеличение площади поверхности насадки. Для того чтобы создать требуемую поверхность контакта фаз необходимо уменьшать размер элементов насадки, что приводит к увеличению гидравлического сопротивления при увеличении скорости подачи реагентов. Следовательно, необходимо искать оптимум в этом вопросе. При проведении адсорбции температура не является управляющим параметром, так как при увеличении температуры растворимость газа в жидкости уменьшается, и увеличение температуры начинают только в том случае, если общая скорость абсорбции лимитируется химической реакцией. Наибольшую сложность для рассмотрения представляют процессы в системе газ – твёрдое вещество. В общем случае процесс можно представить как совокупность 11 стадий: 1-я стадия: диффузия газообразного реагента к поверхности твёрдой частицы (внешняя диффузия). 2-я стадия: диффузия газообразного реагента через слой продукта к поверхности раздела фаз (внутренняя диффузия). 3-я стадия: адсорбция газообразного реагента на поверхности раздела фаз. 4-я стадия: растворение газообразного реагента в твёрдом непрореагировавшем исходном веществе. 5-я стадия: диффузия от поверхности раздела фаз к потенциальному центру образования ядра новой фазы. 6-я стадия: химическая реакция. Далее в обратной последовательности (5-я, 4-я, 3-я, 2-я, 1-я расшифровать). Все 11 стадий наблюдаются в том случае, если уравнение реакции имеет вид: Атв + Вгаз = Ств + Dгаз. Если же: Атв = Ств + Dгаз , то шесть стадий, начиная от химической реакции (с 6-ой по 11-ю). Если: Атв + Вгаз = Ств, то шесть стадий, начиная с диффузии газообразного реагента к поверхности твёрдой частицы (с 1-ой по 6-ю).
Для описания кинетики твёрдофазного взаимодействия используется три основные модели образования ядер новой фазы. Первая модель. Образование ядер новой фазы происходит с одинаковой вероятностью на всей внешней поверхности твёрдой частицы при реализации физических условий процесса. Такая модель может быть применена при рассмотрении процессов разложения твёрдого материала, если температура процесса выше, чем температура начала разложения. В этом случае при реализации физических условий процесса вся поверхность твёрдой частицы покрывается слоем продукта, и дальнейшее продвижение к поверхности раздела фаз обуславливается только диффузионными сопротивлениями, обусловленными как пористостью материала, так и размером твёрдых частиц. Вторая модель. Образование ядер новой фазы на активных центрах происходит с одинаковой вероятностью. В качестве активных центров рассматривают дефекты кристаллической решётки твёрдого материала и включения микропримесей, которые обязательно присутствуют в материале. Согласно этой модели считается, что активные центры равномерно распределены по поверхности твёрдой частицы. И при реализации физических условий процесса на поверхности твёрдой частицы образуется фиксированное количество ядер новой фазы. Далее наблюдается рост ядер, что в начальный период времени приводит к увеличению поверхности раздела фаз, а в дальнейшем к её уменьшению. Математически эта модель описывается уравнением сжимающейся сферы: где: x – степень превращения твёрдого материала, k – константа скорости в соответствии с уравнением Аррениуса,
Модель сжимающейся сферы наиболее хорошо описывает процессы разложения твёрдого материала и некоторые процессы, связанные с присоединением газообразного реагента. Третья модель. Модель экспоненциального роста числа ядер новой фазы. Универсальна, описывает любой процесс. Предполагает, что активные центры на поверхности твёрдой частицы энергетически неоднородны. При реализации физических условий процесса ядра новой фазы образуются на активных центрах, обладающих наибольшей избыточной энергией. Появление поверхности раздела фаз приводит к активации центров, обладающих меньшей избыточной энергией в первоначальный момент времени. Зависимость скорости процесса от времени обработки твёрдого материала.
Участок О–А: индукционный период. Он предназначен для накопления энергии в твёрдом веществе. Считается, что в течение индукционного периода протекают первичные превращения, приводящие к возникновению первых ядер новой фазы. Очевидно, что продолжительность индукционного периода зависит от температуры. Участок А–С: период ускорения. На этом участке протекают два параллельных процесса: образование ядер новой фазы и рост уже образовавшихся. Разбит на две части, чтобы показать, что на начальном этапе (участок А–В) рост связан именно с увеличением количества ядер новой фазы, а на участке В–С – с ростом ядер. Участок С–Д: период максимальной скорости. В точке максимума прекращается образование ядер новой фазы. Участок Д–Е: период спада. В точке Д растущие ядра начинают соприкасаться между собой: из плоских превращаются в шарообразные. С точки Е процесс переходит в диффузионную область. С этой точки вся поверхность частицы покрыта ядрами новой фазы. Эта модель описывается уравнением Ерофеева: n – постоянная Ерофеева. Её физический смысл связан с количеством ядер новой фазы, которое активирует одно образовавшееся ядро. Эта величина определяется экспериментально.
Лекция №12 Лекция №1 Введение Химическая технология – это наука об экономически и экологически обоснованных методах переработки сырья в средства производства и предметы потребления. Химическая технология состоит из двух основных блоков: 1) Изучение теоретических основ протекания химико-технологических процессов на молекулярно-кинетическом уровне. Этот блок включает изучение законов термодинамики и кинетики. 2) Теоретические основы функционирования химического реактора. Первое приближение к физхимии, второе к процессам и аппаратам. Основная задача нашего курса: получение навыков и решения двух задач: 1) Задача проектирования химического реактора. Суть задачи: при известных значениях управляющих параметров необходимо рассчитать объем реактора, который обеспечивает требуемые показатели интенсивности работы реактора. 2) Задача моделирования реактора. Суть задачи: при известном объеме реактора исследуется влияние управляющих параметров на величину показателей интенсивности работы реактора. Любой химко-технологический процесс состоит как минимум из 3 стадий: 1 стадия – подвод реагентов к поверхности контакта (раздела) фаз или в объем другой фазы. 2 стадия – непосредственное химическое превращение. 3 стадия – отвод продуктов от поверхности раздела фаз или из объема другой фазы. Каждая из стадий протекает со своей скоростью, но определяющей является стадия, протекающая с наименьшей скоростью, и все остальные стадии подстраиваются под самую медленную. Соответственно, стадия процесса, обладающая наименьшей скоростью, называется лимитирующей стадией. Если скорость первой или третей стадии меньше, чем скорость второй, то процесс протекает в диффузионной области и в качестве управляющих выступают макрокинетические параметры, к которым относятся: 1)линейная скорость подачи реагентов. 2)степень перемешивания реагентов. 3)размеров единичных элементов, принимаемых участие в процессы
 
где U – скорость диффузии; D – скорость диффузии, так он зависит от температуры, температура будет влиять слабо (если E мала), z – концентрация компонента. Независимо от того, какая реакция, скорость будет пропорциональна концентрации в первой степени. Если скорость второй стали меньше, чем скорость первой и третей стали, то процесс протекает в кинетической области и управляющими являются микрокинетические параметры: температура, давление, концентрация участников процесса. Температура влияет в соответствии с уравнением Аррениуса:
где EА - энергия активации реакции,[Дж/моль]; R=8,31 Дж/моль∙К Энергия активации – минимальный избыток энергии, который необходимо сообщить реагирующей системе, чтобы произошел элементарный акт химической реакции где Т – температура в абсолютной шкале Кельвин. k0 – предэкспоненциальный множитель. Давление Концентрации Рассмотрим реакцию: aA + bB = cC +dD Реакция является формально простой, т.е. химическая реакция протекает в один этап. U=k[A]a [B]b где a, b - степени молекулярности по компоненту. Концентрация – отношение конкретного количества вещества к суммарному количеству вещества. Мольная доля – отношение числа молей компонента к суммарному числу молей компонентов в смеси. Моль – количество вещества, содержащее такое же число структурных единиц, которые содержатся в 12 г изотопа С12. Объемная доля – отношение объема данного вещества к суммарному объему вещества. Величина используется в основном для газов. Обычно используется в системах жидкость – жидкости газофазных процессах. Массовая доля – отношение массы компонента к суммарной массе. Обычно используется для процессов с участием твердой фазы, технически реализовать проще. Для газов объемные и массовые доли совпадают.
Лекция №2 Степень превращения – отношение количества вещества, вступившего в реакцию к начальному количеству вещества. В том случае, если исходные реагенты находятся в стехиометрическом соотношении, степени превращения по реагентам совпадают.
В подавляющем большинстве случаев реагенты подаются в нестехиометрическом соотношении, поэтому практическую ценность имеет степень превращения вещества, находящегося в недостатке. Выход продукта – отношение производительности по продукту к максимально возможной производительности по рассматриваемому веществу. В принципе, выход по продукту численно совпадает со степенью превращения ключевого компонента. Степень превращения обозначается Х, а выход продукта – f с подстрочным индексом, указывающим на вещество, по которому взят это показатель.
Расходный коэффициент – это количество исходного реагента, которое необходимо для производства единицы количества продукта. Различают теоретический расходный коэффициент, который рассчитывается на основании стехиометрического уравнения и практический расходный коэффициент, который учитывает чистоту сырья и степень превращения сырья. Теоретический расходный коэффициент рассчитывается:
Для технических расчетов принимаем, что газы SO2 и SO3 идеальны, то 1 кмоль занимает объем 44.8 м3. Таким образом, отношение заменяют отношением молярных масс.
Селективность – величина, которая используется в том случае, если в реакторе могут протекать одновременно 2 и более реакции. Интегральная селективность – это отношение производительности по ключевому компоненту в целевой реакции к суммарной производительности по ключевому компоненту по всем реакциям, протекающим в реакционном объеме. Величина интегральной селективности может меняться от 0 до 1. Если интегральная селективность равна единице, то все побочные реакции заблокированы. Если она р   Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право...  Что вызывает тренды на фондовых и товарных рынках Объяснение теории грузового поезда Первые 17 лет моих рыночных исследований сводились к попыткам вычислить, когда этот...  ЧТО ПРОИСХОДИТ ВО ВЗРОСЛОЙ ЖИЗНИ? Если вы все еще «неправильно» связаны с матерью, вы избегаете отделения и независимого взрослого существования...  ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала... Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|