|
|
Кинетические уравнения реакцийКинетическое уравнение необратимой реакции первого порядка Рассмотрим необратимую (одностороннюю) реакцию распада: A ® B + D. Кинетическое уравнение:
Начальные условия: концентрация вещества А в начальный момент времени (t =0) равна CA 0. Уравнения данного типа решаются методом разделения переменных:
при t =0; C = CA 0
Рис. 6‑4 Изменение концентрации вещества А во времени при протекании односторонней реакции первого порядка (CA 0=1) Поскольку концентрация вещества А уменьшается в ходе реакции (рис.6.4) и асимптотически приближается к нулю, рассчитать точно время полного превращения вещества А невозможно. Для оценки времени протекания реакции используется такая характеристика, как время полупревращения (полураспада) – время, за которое прореагировала половина исходного вещества, т. е. концентрация вещества А уменьшилась в два раза ( Кинетическое уравнение необратимой реакции второго порядка. К необратимым реакциям второго порядка относятся химические реакции типа: A + A ® A2, A + B ® AB, A + BС ® AB + С. Рассмотрим как наиболее простую первую реакцию. Ее кинетическое уравнение имеет вид
Начальные условия: концентрация вещества А в начальный момент времени (t =0) равна cA 0:
при t =0; С = СA 0
Рис. 6‑5 Изменение концентрации вещества А во времени при протекании реакции второго порядка (C A0=1) Зависимость концентрации вещества от времени для реакций второго порядка (рис. 6.5) линейна в координатах Время полупревращения для реакций второго порядка зависит от исходной концентрации вещества А: Реакции нулевого порядка. Скорость реакций нулевого порядка не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях):
Кинетическое уравнение реакций нулевого порядка имеет вид
Изменение концентрации реагирующих веществ во времени будет описываться уравнением
Время полупревращения Кинетическое уравнение обратимой реакции первого порядка. Изменение концентрации исходных веществ и продуктов реакции во времени в случае протекания обратимой (двусторонней) реакции можно показать на примере реакции первого порядка: А↔В. Согласно закону действующих масс скорость прямой и обратной реакций будут описываться уравнениями
Изменение концентраций исходного вещества А и продукта В определяется разностью скоростей прямого и обратного процессов:
Кинетические уравнения содержат три переменные: CA,CB и t. Для интегрирования одну необходимо исключить. Это можно сделать на основе материального баланса. Пусть в начальный момент времени при t =0 концентрация исходного вещества А равняется C 0 A , а концентрация продукта В – C 0 B , к моменту времени t согласно уравнению реакции концентрации реагентов изменятся на величину x: CA = CA 0 – x, CB = CB 0 + x. Тогда и соответственно Учитывая, что при t =0 x =0, решением уравнения будет:
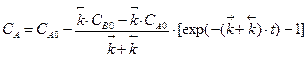 , ,
Изменение концентрации веществ А и В во времени приведено на рис.6.6.
Рис. 6‑7 Изменение во времени скоростей прямой и обратной реакций первого порядка А↔В: По достижении равенства скоростей прямой и обратной реакции (рис.6.7) концентрации исходного вещества и продукта изменяться не будут (в данном примере СА р=0,167; СВ р=0,833), система придет в состояние равновесия. Кинетические уравнения последовательных и параллельных реакций. Принцип независимости протекания реакций заключается в том, что если в системе происходит несколько элементарных реакций, то каждая из них протекает по тем же законам, как и в отсутствии других реакций. Следовательно, если в нескольких реакциях участвует одно и то же вещество, то изменение его концентрации будет равно алгебраической сумме скоростей каждой реакции, умноженной на стехиометрический коэффициент этого вещества в данной реакции. В случае последовательных реакций вещество, образующееся в первой реакции, является исходным для другой. Например, последовательная односторонняя реакция первого порядка:
Система кинетических уравнений для нее будут иметь вид:
Результаты численного решения уравнений приведены на рис.6.8.
Рис. 6‑8 Зависимость концентрации исходного (CA) промежуточного (CB) и конечного (CD) веществ от времени для последовательной односторонней реакции первого порядка (k 1 = 0,5; k 2 = 0,3; C 0 A =1).
Система кинетических уравнений в этом случае будет иметь вид:
Аналогичным образом составляется система дифференциальных кинетических уравнений и для более сложных реакций. Например, параллельно-последовательные, с реакциями, как первого, так и второго порядков:
Такие системы уравнений решают, как правило, численными методами.   Что вызывает тренды на фондовых и товарных рынках Объяснение теории грузового поезда Первые 17 лет моих рыночных исследований сводились к попыткам вычислить, когда этот...  Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор...  ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала...  Что будет с Землей, если ось ее сместится на 6666 км? Что будет с Землей? - задался я вопросом... Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|