|
|
Раздел 1. Основы строения веществаСтр 1 из 2Следующая ⇒ ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ ЧАСТЬ 1
ОМСК 2003 Министерство путей сообщения Российской Федерации Омский государственный университет путей сообщения _____________________
И. М. Зырянова, Л. Н. Круглова
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Часть 1
Утверждено редакционно-издательским советом университета в качестве методических указаний к решению задач
Омск 2003
УДК 546. ББК 24.11я7
Основные понятия и законы химии: Методические указания к решению задач / И. М. Зырянова, Л. Н. Круглова. Омский гос. ун-т путей сообщения. Омск, 2003. 45 с.
Методические указания содержат программу по курсу ²Химия² для студентов нехимических специальностей, краткие теоретические сведения, примеры решения задач различной степени сложности, контрольные задания по основным стехиометрическим законам химии и концентрации растворов. Методические указания предназначены для проведения практических аудиторных занятий и контрольных работ студентов. Могут быть использованы для самостоятельного изучения основ химии.
Библиогр.: 6 назв. Табл. 10. Рецензенты: доктор техн. наук В. В. Лукин; канд. техн. наук В. А. Мухин.
С Омский гос. университет путей сообщения, 2003
СОДЕРЖАНИЕ
Введение….................................................................................................................5 1. Рабочая программа по курсу ²Общая химия²....................................................6 1.1. Раздел 1. Основы строения вещества...............................................................6 1.2. Раздел 2. Взаимодействие веществ...................................................................6 1.3. Перечень лабораторных работ......................…................................................7 1.4. Темы семинарских занятий...............................................................................8 2. Основные теоретические положения и условные обозначения........................8 2.1. Основные теоретические положения................................................................8 2.2. Условные обозначения......................................................................................12 3. Примеры решения задач и правила их оформления.........................................14 4. Контрольные задания...........................................................................................16 5. Дополнительные задания.....................................................................................25 6. Программированные задания..............................................................................28 6.1. Пример оформления программированного задания 1...................................28 6.2. Программированное задание 1.........................................................................32 6.3. Программированное задание 2.........................................................................33 6.4. Свойства неорганических веществ. "Цепочки" превращений......................34 7. Задачи повышенной сложности..........................................................................36 Библиографический список....................................................................................37 Приложения..............................................................................................................38
ВВЕДЕНИЕ
В соответствии с учебным планом химия является одной из общеобразовательных дисциплин. Ее изучение как одной из важнейших фундаментальных наук необходимо для формирования у студентов целостного естественнонаучного мировоззрения. Вузовская программа по химии предусматривает дальнейшее усвоение студентами техники химических расчетов, приобретение ими навыков самостоятельного выполнения химических экспериментов. Инженер должен обладать достаточными знаниями в области химии, поскольку это способствует развитию логического мышления, позволяет получить современное научное представление о веществе как одном из видов движущейся материи, о механизме и условиях превращения одних веществ в другие. Без знания химии невозможно решение экологических сырьевых и энергетических проблем, которые в последние годы становятся все более актуальными. Усвоение курса химии будет успешным только при систематических занятиях. Изучение химии должно сопровождаться выполнением упражнений и решением задач. Решение задач – один из лучших методов прочного усвоения, проверки и закрепления теоретического материала. Данные методические указания содержат набор задач различной степени сложности, что позволяет преподавателю дифференцированно подходить к проведению аудиторных занятий. Для успешной подготовки рекомендуется предварительно познакомиться с теоретическим материалом [2, 3], проанализировать решение типовых задач [1, 4, 5], а также разобрать примеры решения задач, приведенные в данной работе. РАБОЧАЯ ПРОГРАММА ПО КУРСУ «ОБЩАЯ ХИМИЯ»
Введение
Химия как часть естествознания. Предмет химии. Вещество. Виды химических реакций. Связь химии с другими науками. Химия и проблемы экологии.
Перечень лабораторных работ
1. Скорость химических реакций. 2. Химическое равновесие. 3. Свойства водных растворов электролитов. Водородный показатель среды. 4. Гидролиз солей. 5. Окислительно-восстановительные реакции. Марганец. 6. Электродвижущая сила и напряжение гальванического элемента. 7. Электролиз. Электрохимический эквивалент. 8. Коррозия металлов. Защита металлов от коррозии. 9. Получение гальванопокрытий. Темы семинарских занятий 1. Строение атома. 2. Метод валентных связей. Гибридизация. 3. Комплексные соединения. 4. Энергетические характеристики химических процессов. Термохимические расчеты. (D, H, S, G. Закон Гесса.) 5. Закон действующих масс. Константа равновесия. 6. Химическая кинетика. Катализ. 7. Способы выражения концентраций растворов. Их взаимный пересчет. 8. Электрохимические процессы. 9. Химия металлов. Металлы и сплавы. 2. Основные теоретические положения И Условные обозначения В контрольное задание включены задачи по следующим темам курса общей химии: 1) основные понятия и законы химии (молярная масса, моль, вывод химических формул, расчеты по химическим формулам, расчеты по химическим уравнениям, молярный объем газов, эквивалент, эквивалентная масса); 2) концентрация растворов. Условные обозначения В соответствии с требованиями Международного союза теоретической и прикладной химии используются названия величин (индекс х указывает на то, что данная величина относится к веществу х), которые сведены в табл. 2.1.
Таблица 2.1 Условные обозначения величин
3. Примеры решения задач и правила их оформления Задача 1. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите эквивалентную массу этого металла.
m m(MеCl) = 2,78 г MeNO3 ® MeCl.
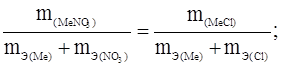
3,31(х + 35,5) = 2,78(х + 62); х = 103, 5 (г/моль). Ответ: mЭ(Ме) = 103,5 г/моль.
Задача 2. При растворении в кислоте 2,33 г смеси железа и цинка было получено 896 мл водорода (н. у.). Сколько граммов каждого из металлов содержалось в смеси?
m(Fе,Zn) = 2,33 г Пусть m(Fе) в смеси равна х, тогда m(Zn) - (2,33 – х).
Найти: m(Zn) -? m(Fе) -?
Составляем уравнение с одним неизвестным. Поскольку Vобщ = V1 + V2, то Ответ: m(Fе) = 1,68 г; m(Zn) = 0,65 г.
Задача 3. При растворении смеси опилок меди, железа и золота в концентрированной азотной кислоте образовалось 6,72 л газа и 8,55 г нерастворившегося осадка. При растворении такой же навески исходной смеси в соляной кислоте выделилось 3,36 л газа. Определите процентный состав исходной смеси.
V1 (газа) = 6,72 л 1) Поскольку из исходной смеси металлов с концен- m(осадка) = 8,55 г трированной азотной кислотой реагирует только медь, V2 (газа) = 3,36 л можно записать уравнение реакции и слить количество
Найти: w(состав) -? Cu + HNO3 = Cu(NO3)2 + 2 NO2 + 2H2O
1 моль (64 г) Cu взаимодействует с 2 моль (44,8 л) NO2; х1 - 0,3 моль NO2; х1 = 0,15 моль; m = n×m = 0,15×64 Þ m = 9,6 г (Cu). 2) Медь и золото в соляной кислоте не растворяются. Следовательно, по количеству выделившегося водорода можно вычислить исходное количество железа: Fe + 2HCl = FeCl2 + H2. 1 моль (56 г) Fe взаимодействует с 1 моль (22,4 л) H2; х2 - 0,15 моль (3,36 л) H2; х2 = 0,15 моль; m = n×m = 0,15×56 Þ m = 8,4 г (Fe). Тогда m(Au) = 8,55 – 8,4 = 0,15 (г); Sm(Me) = 9,6 + 8,4 + 0,15 = 18,15 (г).
Ответ: wCu = 52,9 %; wFe = 46,3 %; wAu = 0,8 %. 4. КОНТРОЛЬНЫЕ ЗАДАНИЯ 4.1. При разложении 3,64 г соли образовался 1 л кислорода и KCl. Определите простейшую формулу соли. 4.2. При сжигании 0,29 г газообразного углеводорода получили 448 мл оксида углерода (IV) и 0,45 г воды. Определите молекулярную формулу углеводорода. 4.3. При сжигании 1,28 г органического соединения образовалось 1,76 г диоксида углерода и 1,44 г воды. Относительная плотность паров этого вещества по водороду равна 16. Найдите истинную формулу вещества. 4.4. При полном сгорании 1,10 г органического вещества образовалось 2,2 г оксида углерода (IV) и 0,90 г воды. Найдите молекулярную массу вещества, если 0,7 л его паров, приведенных к нормальным условиям, имеют массу 2,75 г. 4.5. Установите истинную формулу органического вещества, если при сжигании 2,40 г его было получено 2,69 л (н. у.) диоксида углерода и 2,86 г воды. Плотность паров этого вещества по водороду равна 30. 4.6. Продуктами сгорания 3.20 г вещества являются азот объемом 2,24 л (н.у.) и вода массой 3,60 г. Определите формулу соединения, если плотность паров по водороду равна 16. 4.7. При сжигании 1,88 г бромсодержащего вещества было получено 0,88 г СО2 и 0,3 г Н2О. После превращения всего брома, содержащегося в навеске, в бромид серебра, получено 3,76 г AgBr. Плотность паров вещества по водороду равна 94. Определите молекулярную формулу вещества. 4.8. Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода (IV) объемом 6,72 л (н. у.) и вода массой 6,3 г. Плотность паров этого вещества по водороду 4.9. Один литр газа при нормальных условиях имеет массу 0,77 г. Массовые доли азота и водорода составляют 82,35 и 17,65 %. Выведите молекулярную формулу газа. 4.10. При полном сгорании 2,3 г вещества образовалось 4,4 г оксида углерода (IV) и 2,7 г воды. Масса 1 л паров этого вещества при нормальных условиях равна 2,05 г. Выведите его молярную формулу. 4.11. Неизвестное вещество массой 200 г прокалили с углем, при этом образовалось 36,8 г оксида углерода (IV) и 173,2 г свинца. Выведите формулу этого вещества. 4.12. При давлении 98,7 кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найдите объем газа при нормальных условиях. 4.13. При разложении 49 г неизвестного вещества выделилось 13,44 л кислорода и осталось твердое вещество, содержащее 52,35 % калия и 47,65 % хлора. Определите формулу неизвестного вещества. 4.14. При взаимодействии средней соли неизвестного металла, окрашивающей пламя в желтый цвет, с избытком соляной кислоты выделилось 4,48 г оксида серы, содержащего 50 % серы. Определите формулу и количество исходной соли. 4.15. Вычислите мольную массу ацетона, если масса 500 мл его паров при 87°С и давлении 96 кПа (720 мм рт. ст.) равна 0,93 г. 4.16. При взаимодействии 19,2 г неизвестного металла с разбавленным раствором кислоты образуется соль металла (II) и выделяется 4,48 л газа, содержащего 46,67 % азота и 53,33 % кислорода. Плотность газа по водороду равна 15. Укажите символ металла. 4.17. Какая соль образуется в результате взаимодействия 67,2 л сероводорода с 375 мл 25%-го раствора NaOH (r = 1,28 г/мл). Определите рН раствора полученной соли. 4.18. К раствору, содержащему 42,6 г нитрата алюминия, прилили раствор, содержащий 37,2 г карбоната натрия. Осадок прокалили. Определите массу осадка после прокаливания. 4.19. К водному раствору, содержащему 52 г AlCl3, прибавили раствор, содержащий 64 г Na2S. Определите массу образовавшегося осадка. 4.20. К раствору, содержащему 0,20 моля хлорида железа (III), прибавили 0,24 моля едкого натра. Сколько молей гидроксида железа (III) образовалось в результате реакции и сколько молей хлорида железа осталось в растворе? 4.21. Газ, получаемый при сжигании сероводорода в избытке кислорода, прореагировал с 250 мл 25%-го раствора гидроксида натрия (r = 1,28 г/мл) с образованием кислой соли. Рассчитайте объем израсходованного сероводорода. 4.22. При пропускании сероводорода через 16 г раствора сульфата меди (II) может образоваться 1,92 г черного осадка. Рассчитайте концентрацию использованного раствора сульфата меди и объем израсходованного сероводорода. 4.23. Никель получают восстановлением оксида никеля (II) углеродом по реакции: NiO + C = Ni + CO. Какую массу угля надо взять для получения 354 г никеля, если массовая доля углерода в угле составляет 92 % и для реакции нужен двукратный избыток углерода? 4.24. При нагревании 19,6 г смеси оксида кальция с 20 г кокса получили 16 г карбида кальция. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90 %. 4.25. Какой объем воздуха потребуется для сжигания 10 кг угля? Объемная доля кислорода в воздухе составляет 21 %. Уголь содержит углерод (массовая доля 96 %), серу (0,8 %) и негорючие примеси. Объем воздуха рассчитайте при температуре 30°С и давлении 202,6 кПа. 4.26. Сырье для алюминотермического получения хрома кроме оксида хрома (III) содержит различные примеси, массовая доля которых равна 20 %. К такому сырью массой 28 г добавили 10 г технического алюминия и осуществили реакцию восстановления. Какая масса хрома образовалась, если массовая доля алюминия в техническом металле составляет 97,2 %, а выход хрома – 75 %? 4.27. Рассчитайте массу карбоната натрия, получающегося при пропускании оксида углерода (IV) массой 0,88 г через раствор массой 10 г с массовой долей гидроксида натрия 20 %. 4.28. При осуществлении превращений по схеме J2 ® HJ ® KJ ® AgJ получили йодид серебра массой 61,1 г, причем выход составил 65 % от теоретически возможного. Какая масса йода была взята? Напишите уравнения в молекулярной и ионно-молекулярной форме. 4.29. Какая масса перманганата калия потребуется для окисления 8 г сульфита калия, находящегося в нейтральном растворе? 4.30. При взаимодействии 16 г раствора серной кислоты с избытком раствора хлорида бария выделился осадок массой 5,7 г. Определите массовую долю серной кислоты в исходном растворе. 4.31. Через 50 г раствора с массовой долей йодида натрия 15 % пропустили избыток хлора. Выделился йод массой 5,6 г. Определите выход продукта реакции. 4.32. Газ, полученный при взаимодействии сульфида железа (II) массой 17,6 г с избытком серной кислоты пропустили через раствор сульфата меди (II) массой 300 г. Образовался осадок массой 14,4 г. Определите массовую долю сульфата меди (II) в растворе. 4.34. Вычислите массу оксида углерода (IV), который можно получить при взаимодействии 7 г карбоната кальция с раствором соляной кислоты массой 30 г, в котором массовая доля HCl составляет 20 %. 4.35. Железо массой 12,2 г сплавили с серой массой 6,4 г. К полученному продукту добавили избыток соляной кислоты. Выделяющийся газ пропустили через раствор массой 200 г с массовой долей хлорида меди (II) 15 %. Какая масса осадка образовалась? 4.36. Технический цинк массой 1,32 г обрабатывали избытком раствора серной кислоты. Объем выделившегося водорода занял при нормальных условиях 448 мл. Определите массовую долю цинка в техническом металле. 4.37. К 200 г раствора с массовой долей серной кислоты 8 % прилили 50 г раствора гидроксида натрия с массовой долей 12 %. Какова масса соли, которую выделили из полученного раствора? 4.38. Какой объем концентрированной серной кислоты (r = 1,84 г/мл), в котором массовая доля кислоты составляет 98 %, необходимо взять для полного растворения меди массой 8 г? Какой объем оксида серы (IV), измеренный при нормальных условиях, выделится при этом? 4.39. Какой объем воздуха потребуется для сжигания 1 м3 газа, имеющего следующий состав по объему: 50 % H2, 35 % CH4, 8 % CO, 2 % C2H4 и 5 % негорючих примесей? Объемное содержание кислорода в воздухе равно 21 %. 4.40. Хватит ли раствора массой 120 г с массой долей перманганата калия 4 % для окисления раствора массой 50 г с массовой долей сульфида натрия 3 %, который также содержит гидроксид калия? 4.41. Определите количество и состав соли, образовавшейся при растворении в 38,4 мл 25%-го раствора гидроксида натрия (r = 1,25 г/мл) газа, получившегося в результате сжигания на воздухе 6,72 л газообразного вещества, плотность которого по водороду равна 8 и состоящего из 75 % углерода и 25% водорода. 4.42. При действии соляной кислоты на 22,4 г неизвестного металла образуется хлорид металла (II) и выделяется 8,96 л газа. Определите неизвестный металл. 4.43. Сколько граммов осадка может быть получено при слиянии 33,3 г 20%-го раствора хлорида кальция с некоторой массой раствора карбоната натрия, если известно, что при ее обработке избытком соляной кислоты выделяется 1,12 л (н. у.) газа? 4.45. Газ, полученный при сжигании 4,48 л (н. у.) метана, был поглощен 14 мл 40%-го раствора гидроксида натрия (r = 1,43 г/мл). Определите в граммах массу образовавшейся соли. 4.46. Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом образовалось 5,6 л газа (н. у.). Нерастворившийся остаток отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Определите массовую долю меди в сплаве. 4.47. При разложении 7,1 г смеси карбонатов кальция и магния выделилось 3,3 г углекислого газа. Определите содержание карбонатов кальция и магния в смеси. 4.48. При растворении 6 г сплава меди, железа и алюминия в соляной кислоте образовалось 3,024 л (н. у.) водорода и 1,86 г нерастворимого остатка. Определите процентный состав сплава. 4.49. При растворении 9 г сплава алюминия с магнием в кислоте выделилось 10,08 л водорода (н. у.). Определите процентный состав сплава. 4.50. При растворении 9 г сплава магния с алюминием в серной кислоте образовалось 32,88 г безводных сульфатов магния и алюминия. Определите процентный состав сплава. 4.51. При обработке водой 5,28 г сплава калия и натрия выделилось 1,792 л водорода (н. у.). Определите процентный состав сплава. 4.52. При обработке 9,04 смеси хлорида и нитрата калия серной кислотой получили 8,7 г сульфата калия. Определите состав смеси. 4.53. На растворение смеси цинка и оксида цинка израсходовано 132,8 мл 20 %-го раствора соляной кислоты (r = 1,1 г/мл). Выделившийся газ после сжигания образует 3,6 г воды. Определите процентное содержание металла в смеси. 4.54. При растворении в серной кислоте 2,5 г сплава цинка с магнием выделилось 1,43 л водорода при температуре 26°С и давлении 1,2.105 Па. Определите в процентах массовые доли компонентов сплава. 4.55. Смесь железа с железной окалиной массой 7,2 г восстановили водород. Далее на продукты реакции подействовали соляной кислотой, при этом выделилось 2,24 г газа при нормальных условиях. Определите массовые доли исходных компонентов. 4.56. При растворении 1,11 г смеси железных и алюминиевых опилок в 18,25%-м растворе соляной кислоты (r = 1,09 г/см3) выделилось 0,672 л водорода при н.у. Найдите массовую долю каждого из металлов в смеси и определите объем 18,25%-го раствора соляной кислоты, израсходованной на растворение 1,11 г смеси. 4.57. Сплав меди с алюминием массой 12,8 г обработали избытком соляной кислоты. Остаток промыли и растворили в концентрированной азотной кислоте. Этот раствор выпарили, а сухой остаток прокалили. Масса вещества после прокаливания 4 г. Определите процентное содержание меди в сплаве. 4.58. При взаимодействии соляной кислоты с 1,20 г сплава магния с алюминием выделилось 1,42 л водорода, измеренного при 23°С и давлении 100,7 кПа. Вычислить процентный состав сплава (по массе). 4.59. Смесь водорода и хлороводорода объемом 7 л (н. у.) пропустили через избыток раствора нитрата серебра, получив осадок массой 28,7 г. Определите объемную долю водорода в смеси. 4.60. На смесь меди и оксида меди (II) массой 75 г подействовали избытком концентрированной азотной кислоты. При этом образовался газ объемом 26,88 л (н. у.). Определите массовую долю оксида меди (II) в исходной смеси. 4.61. При действии соляной кислоты на смесь железа с алюминием массой 16,6 г выделился водород объемом 10,13 л. Объем измерен при температуре 0°С и давлении 112 кПа. Определите массовую долю железа в смеси. Какой объем раствора с массовой долей кислоты 20 % и r = 1,12 г/мл вступил в реакцию? 4.62. Для определения массовой доли оксида кальция в смеси его с карбонатом кальция образец смеси массой 0,8 г обработали раствором соляной кислоты. В результате выделился газ объемом 112 мл (н. у.). Определите массовую долю оксида кальция в смеси. 4.63. При обработке смеси гидроксида и гидрокарбоната калия избытком раствора соляной кислоты образовалось 22,35 г хлорида калия и выделилось 4,48 л газа. Рассчитайте процентный состав исходной смеси. 4.64. Сплав меди с алюминием массой 20 г обработали раствором щелочи. Остаток растворили в концентрированной азотной кислоте, образовавшуюся при этом смесь выделили и прокалили. Масса остатка после прокаливания составляет 8 г. Определите объем израсходованного 40%-го раствора гидроксида натрия (r = 1,4 г/мл). 4.65. Образец мела содержит карбонат кальция, карбонат магния и некарбонатные примеси. Массовая доля этих примесей составляет 3 %. При действии избытка соляной кислоты на образец массой 51,98 г получили газ объемом 11,31 л (н. у.). Вычислите массу карбоната кальция во взятом образце. 4.66. Образец сплава цинка, алюминия, меди массой 20 г обработали избытком концентрированного раствора щелочи. При этом выделился газ объемом 7,1 л (н.у.). Масса нерастворимого осадка составила 2 г. Определите массовые доли металлов в сплаве. 4.67. Смесь хлороводорода и бромводорода массой 5,51 г растворили в воде. На нейтрализацию полученного раствора затратили 5,04 г гидроксида калия. Определите массовые доли галогеноводородов в исходной смеси. 4.68. Образец смеси бромида и йодида калия массой 2,85 г растворили в воде. Через раствор пропустили избыток хлора. Раствор упарили досуха и прокалили. В остатке получили соль, при взаимодействии которой с раствором нитрата серебра образовался осадок массой 2,87 г. Определите массовую долю бромида калия в исходной смеси. 4.69. Сплав натрия и калия массой 13,1 г поместили в воду. Для нейтрализации полученного раствора затратили раствор объемом 109,6 мл с массовой долей азотной кислоты 25 % и плотностью 1,15 г/мл. Чему равна массовая доля натрия в сплаве? 4.70. Какой объем водорода, измеренного при 25°С и давлении 755 мм рт. ст. (100,7 кПа), выделится при взаимодействии с водой 1 г сплава, состоящего из 30 % (масс.) и 70 % (масс.) натрия? 4.71. Железную пластину погрузили сначала в разбавленную серную кислоту, а затем – в раствор сульфата меди. При этом собрано 1,12 л (н. у.) газа, а масса пластины увеличилась на 2,4 г. Сколько граммов железа прореагировало (всего)? 4.72. Цинковая пластинка массой 10 г помещена в раствор сульфата меди. После окончания реакции, когда вся медь выделилась на пластинке, ее промыли, высушили и взвесили. Масса пластинки оказалась равной 9,9 г. Напишите уравнение реакции и определите массу сульфата меди, находящегося в исходном растворе. 4.73. Железную пластину массой 100 г погрузили в раствор медного купороса. Покрывшуюся медью пластину высушили и взвесили, ее масса оказалась равной 101,3 г. Определите массу меди, выделившейся на пластине. 4.74. Цинковую пластинку опустили в раствор нитрата серебра. Какая масса цинка перешла в раствор, если масса раствора уменьшилась на 3,02 г? 4.75. Раствор сульфата двухвалентного металла содержит 1,120 г металла в виде ионов. В раствор погрузили цинковую пластинку. После полного выделения металла на пластинке масса ее увеличилась на 0,470 г. Назовите металл. 4.76. Смесь сероводорода и йодоводорода объемом 1,792 л (н. у.) пропустили через избыток раствора нитрата серебра. При этом образовался остаток массой 19,19 г. Определите массовые и объемные доли газов в исходной смеси. 4.77. Какую массу оксида марганца (VI) и какой объем раствора с массовой долей HCl 36 % и плотностью r = 1,18 г/мл надо взять для получения хлора, который может вытеснить из раствора йодида калия молекулярный йод массой 30,48 г? Принять, что выход реакции на каждой ступени процесса составляет 80 % от теоретически возможного. 4.78. При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определите эквивалентную массу металла. 4.79. Определите эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида. 4.80. Вычислите атомную массу двухвалентного металла и определите, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (н. у.). 4.81. Для растворения 16,8 г металла потребовалось 14,7 г кислоты. Определите эквивалентную массу металла и объем выделившегося водорода (н. у.). 4.82. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислите эквивалентные массы оксида и металла. 4.83. Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определите массу металла. 4.84. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определите эквивалентную массу кислоты. 4.85. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,40 г соли. Вычислите эквивалентные массы вещества и образовавшейся соли. 4.86. Алюминий массой 0,375 г при взаимодействии с кислотой вытесняет 0,468 л водорода (н. у.). Определите эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль. 4.87. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. 4.88. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. 4.89. Оксид трехвалентного металла содержит 31,58 % кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. 4.90. Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н. у.). 4.91. Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: 1) гидрофосфата; 2) дигидрофосфата; 3) ортофосфата. 4.92. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы этого металла? 4.93. На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н. у.). Вычислите эквивалентную, мольную и атомную массы этого металла. 4.94. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? 4.95. На нейтрализацию 0,943 г фосфористой кислоты израсходовано 1,291 г гидроксида калия. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании расчета напишите уравнение реакции. 4.96. Оксид металла содержит 47,06 % кислорода, а соединение того же металла с бромом – 89,88 % брома. Вычислите эквивалентную массу брома. 4.97. Чему равна нормальность 30%-го раствора едкого натра плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. 4.98. Вычислите эквивалентную и молярную концентрации 20,8%-го раствора HNO3 плотностью 1,12 г/мл. Сколько граммов кислоты содержится в 4 л этого раствора? 4.99. Какой объем 20,01%-го раствора соляной кислоты (r = 1,100 г/мл) потребуется для приготовления 1 л 10,17%-го раствора (r = 1,050 г/мл)? 4.100. Какой объем 50%-го раствора КОН (r = 1,538 г/мл) требуется для приготовления 3 л 6%-го раствора (r = 1,048 г/мл)? 4.101. Какой объем 10%-го раствора карбоната натрия (r = 1,105 г/мл) требуется для приготовления 5 л 2%-го раствора (r = 1,02 г/мл)? 4.102. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равны нормальность и титр раствора кислоты? 4.103. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г едкого натра в 40 мл? 4.104. Определите процентную концентрацию сульфата железа (II) в растворе, полученном при растворении 208,5 г железного купороса FeSO4×7H2O в 1291,5 г H2O. 4.105. В лаборатории имеются растворы с массовой долей хлорида натрия 10 и 20 %. Какую массу каждого раствора нужно взять для приготовления 300 г раствора с массовой долей соли 12 %? 4.106. Из фасованной кислоты с r = 1,8402 г/мл и воды необходимо приготовить 10 л аккумуляторной серной кислоты, имеющей плотность r = 1,28 г/мл (для зимнего времени). В каких соотношениях нужно взять кислоту и воду? 4.107. Сколько литров 24%-го раствора едкого кали (r = 1,218 г/мл), необходимого для заливки щелочных аккумуляторов, можно приготовить из 125 л 48%-го раствора гидроксида калия (r = 1,510 г/мл)? 4.108. Сколько 0,20 н едкого кали требуется, чтобы осадить в виде Fe(OH)3 все железо, содержащееся в 0,028 л 1,4 н. FeCl3? 4.109. Каким объемом 4 н. H2SO4 можно полностью разложить 0,65 л 20%-го раствора карбоната калия (r = 1,189 г/мл)? Какой объем займет выделившейся газ при нормальных условиях? 4.110. К 0,05 л 8%-го раствора хлорида марганца (r = 1,085 г/мл) прибавлено 0,20 л 10%-го раствора гидроксида лития (r = 1,107 г/мл). Какое вещество взято в избытке и сколько его осталось после реакции? 4.111. Какова была масса гидроксида алюминия, если для его растворения потребовалось 0,2 л 30%-го раствора азотной кислоты (r = 1,180 г/мл)? Какой объем 2,5 н гидроксида калия необходимо затратить для растворения этого количества гидроксида алюминия? 4.112. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,996°С. Температура кристаллизации бензола 5,5°С. Криоскопическая константа 5,1°. Вычислите мольную массу растворенного вещества. 4.113. Вычислите процентную концентрацию водного раствора сахара C12H22O11, зная, что температура кристаллизации -0,93°С. Криоскопическая константа воды 1,86°. 4.114. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86°. 4.115. Вычислите процентную концентрацию водного раствора глицерина C3H5(OН)3, зная, что этот раствор кипит при 100,39°С. Эбуллиопическая константа воды 0,52°. 4.116. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465°С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. 4.117. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°. Сколько атомов содержит молекула серы в этом растворе? Эбуллиопическая константа бензола 2,57°. 4.118. Определите формулу вещества, содержащего 39,34 % углерода, 8,20 % водорода и 52,46 % серы, если раствор 0,2 г этого вещества в 26 г бензола замерзает при температуре на 0,318° ниже, чем чистый бензол. 4.119. Для приготовления антифриза на 30 л воды взято 9 л глицерина С3Н5(ОН)3. Чему равна температура замерзания приготовленного антифриза? Плотность глицерина равна 1,261 г/мл. 4.120. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г H2O, что   ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры...  Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.)...  Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право...  Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все... Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|