|
|
Кислотные и щелочные аккумуляторы.Аккумулятор – химический источник тока, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию и по мере необходимости отдавать её во внешнюю цепь. Аккумулятор сам не производит электрическую энергию. Он только накапливает её при заряде: пропускание тока от постороннего источника сопровождается превращением электрической энергии в химическую, в результате, аккумулятор сам становится источником тока. При разряде аккумулятора накопленная электрическая энергия расходуется в подключённой к нему внешней цепи (химическая энергия преобразуется в электрическую). При правильной эксплуатации аккумулятор выдерживает несколько сотен циклов заряда и разряда. В зависимости от состава электролита различают: · кислотные · и щелочные аккумуляторы. Простейший кислотный аккумулятор состоит из двух свинцовых электродов, погруженных в раствор серной кислоты.
PbO2+Pb+2H2SO4 2PbSO4+2H2O РbO2 – порошок перекиси свинца; PbSO4 - сернокислый свинец (сульфат свинца).
Рисунок 4.2. Прохождение через электролит положительных и отрицательных ионов при а) разряде и б) заряде кислотного аккумулятора
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы (значительно больший срок службы, чем у кислотных). Полностью заряженный аккумулятор имеет э.д.с. около 2,2 В, приблизительно такое же напряжение на его зажимах, так как внутреннее сопротивление очень мало. При разряде напряжение быстро падает до 1,8–1,7 В, при этом напряжении разряд прекращается во избежание повреждения. Щелочные аккумуляторы. Наиболее распространены никель-железные (НЖ) и никель-кадмиевые (НК) щелочные аккумуляторы. В тех и других активная масса положительного электрода в заряженном состоянии состоит из гидрата окиси никеля NiOOH, к которому добавляют графит и окись бария. Графит увеличивает электропроводность активной массы, а окись бария – срок службы. Активная масса отрицательного электрода никель-железного аккумулятора состоит из порошкового железа с добавками, а никель-кадмиевого аккумулятора из смеси порошкового кадмия и железа. Электролитом служит раствор едкого калия с примесью моногидрата лития, которая увеличивает срок службы аккумулятора. Электрохимические реакции, протекающие при заряде и разряде щелочного аккумулятора, можно представить следующими уравнениями: 2Ni(OOH)+2KOH+Fe
Ni(OОH) – гидрат окись никеля; КОН – едкий калий.
Рисунок 4.3. Полублоки отрицательных и положительных пластин (а) и общий вид (б) никель-железного аккумулятора ТПНЖ, применяемого на тепловозах:
1 – выводной штырь; 2 – шпилька; 3 – положительные пластины; 4 – стальные никелерованные рамки (ламели); 5 – сепараторы; 6 – отрицательные пластины; 7 – корпус; 8 – резиновый чехол; 9 – отверстие с пробкой для заливки электролита

Полностью заряженный аккумулятор имеет э.д.с. приблизительно 1,45 В. Вследствие большого внутреннего сопротивления его напряжение при разряде значительно меньше этого значения. При разряде напряжение быстро падает до 1,3 В, затем медленно до 1 В. Разряжать ниже этого напряжения запрещается. Преимущества щелочных аккумуляторов: · при их изготовлении не используется дефицитный свинец; · они обладают большей выносливостью и механической прочностью, не боятся сильных токов разряда, тряски, ударов и даже коротких замыканий; · при длительном бездействии несут малые потери на саморазряд и не портятся, имеют большой срок службы; · при работе выделяют меньшее количество вредных газов и испарений; · имеют меньший вес; · менее требовательны в отношении постоянного квалифицированного ухода. Недостатками являются: · меньшая э.д.с; · более низкий к.п.д. · более высокая стоимость. Контрольные вопросы
1. Каково назначение аккумулятора? 2. Принцип работы кислотного аккумулятора. 3. Принцип работы щелочного аккумулятора. 4. Достоинства щелочных аккумуляторов. 5. Недостатки щелочных аккумуляторов. 6. Чему равна э.д.с. полностью заряженного аккумулятора? 7. Из чего состоит простейший кислотный аккумулятор? 8. Как называются устройства, преобразующие химическую энергию в электрическую? 9. Что такое электролит? 10. Что такое электролиз? 11. На какие составляющие распадается молекула серной кислоты? 12. Из чего состоит гальванический элемент Вольта? 13. Как происходит поляризация элемента? 14. Какое воздействие оказывают ионы водорода на работу аккумуляторной батареи? 15. Что такое сухой гальванический элемент? 16. Как проходит электрический ток в жидких проводниках? 17. Какова конструкция кислотных аккумуляторов? 18. Расскажите об устройстве щелочных аккумуляторов. 19. Каким образом заряжают аккумуляторы? 20. Что служит признаком конца заряда у кислотного аккумулятора? 21. Что служит признаком конца заряда у щелочного аккумулятора? 22. Как соединяют аккумуляторы в батарею?
4.3. Способы соединения аккумуляторов в батарею Последовательное: когда минус каждого предыдущего источника соединен с плюсом последующего. По второму закону Кирхгофа результирующая э.д.с. равна сумме э.д.с. отдельных аккумуляторов. Чем больше аккумуляторов в цепи, тем больше напряжение на приёмниках. Еб=Е1+Е2+… = nЕа; Ro=R1+R2+…= nRoa; Если батарея будет замкнута на внешнее сопротивление R, то I=nEa/Ron+R. Последовательно соединяют аккумуляторы, когда напряжение потребителя выше напряжения одного аккумулятора. Параллельное: когда положительные зажимы нескольких аккумуляторов соединяют между собой и выводят на общий плюс, и отрицательные зажимы соединяют между собой и выводят на общий минус. Еб=Е1=Е2=…=Еа; Ro=Roa/n; I=Ea/(Ro/n+R).
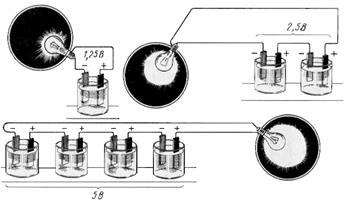
Параллельное соединение применяют, когда напряжение потребителя равно напряжению одного аккумулятора, а ток, необходимый потребителю, больше разрядного тока одного аккумулятора.
Рисунок 4.6. Последовательное (а) и параллельное (б) соединение аккумуляторов Смешанное соединение применяется, когда аккумуляторы не обеспечивают возможности получения необходимого тока и напряжения. На рис. 4.7 в каждой из двух параллельных групп аккумуляторной батареи имеется по два последовательно соединённых аккумулятора.
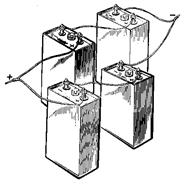
Аккумуляторные батареи в большинстве случаев составляются из последовательно соединённых аккумуляторов. Смешанное и параллельное соединение аккумуляторов применяют редко, т.к. трудно обеспечить равномерное распределение тока между параллельными ветвями.
Контрольные вопросы 1. Какие виды соединения аккумуляторов Вы знаете? 2. В чём суть последовательного соединения аккумуляторов? 3. Какое соединение аккумуляторов называется параллельным? 4. Какое соединение аккумуляторов называется смешанным?
  Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор...  Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право...  ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между...  Что вызывает тренды на фондовых и товарных рынках Объяснение теории грузового поезда Первые 17 лет моих рыночных исследований сводились к попыткам вычислить, когда этот... Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|