Вычисление ЭДС обратимого ГЭ, химического или концентрационного
В электрохимических системах происходит взаимное превращение энергии химических реакций в электрическую энергию и обратно. Применение законов термодинамики к электрохимическим системам позволяет рассчитать значения равновесных электродных потенциалов и э. д. с. электрохимических цепей. Для обратимой реакции 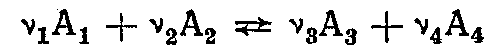
протекающей при постоянных давлении и температуре в электрохимической цепи, максимальная полезная работа выражается уравнением
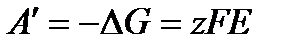 , где Е- эдс элемента , где Е- эдс элемента
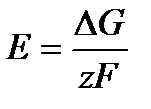
и соответствует электрической работе при э. д. с. цепи Е, равной zFЕ. Отсюда

где z— количество электронов, участвующих в электродных реакциях (одинаковое для обоих электродов); F — число Фарадея.
Если активность каждого участвующего в реакции вещества равна 1, то э. д. с. цепи называется стандартной и равна 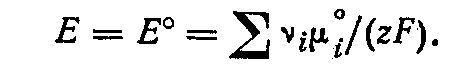
В соответствии с этим уравнение принимает вид
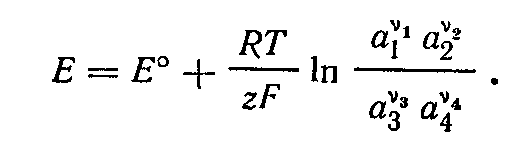
Обозначив  получаем получаем

Из уравнения изотермы химической реакции следует 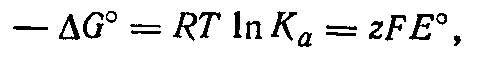
где Ка — константа равновесия реакции (Ка = К°). Отсюда
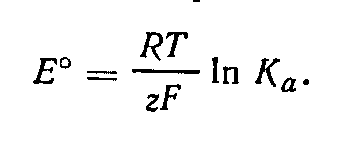
Связь между э. д. с. электрохимической цепи и изменением энтальпии протекающей в ней реакции устанавливается на основании уравнения Гельмгольца — Гиббса
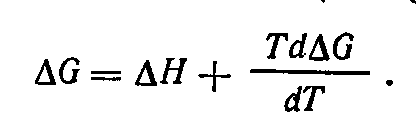
34 Диффузионный потенциал
электрохимические цепи могут содержать несколько электролитов, границам раздела которых соответствуют гальвани-потенциалы, называемые фазовыми жидкостными потенциалами. Длядвух растворов с одинаковым растворителем такой потенциал называется диффузионным. В месте контакта двух растворов электролита КА, отличающихся друг от друга концентрацией, происходит диффузия ионов из раствора 1, более концентрированного, в раствор 2, более разбавленный. Обычно скорости диффузии катионов и анионов различны. Допустим, что скорость диффузии катионов больше скорости диффузии анионов. За некоторый промежуток времени из первого раствора во второй перейдет больше катионов, чем анионов. В результате этого раствор 2 получит избыток положительных зарядов, а раствор 1 — отрицательных. Поскольку растворы приобретают электрические заряды, то скорость диффузии катионов уменьшается, анионов увеличивается, и с течением времени эти скорости становятся одинаковыми. В стационарном состоянии электролит диффундирует как единое целое. При этом каждый раствор имеет заряд, и разность потенциалов, установившаяся между растворами, соответствует диффузионному потенциалу. Расчет диффузионного потенциала в общем случае затруднителен. С учетом некоторых допущений Планком и Гендерсоном выведены формулы для расчета. Так, например, при контакте двух растворов одного и того же электролита с различной активностью ( ) )
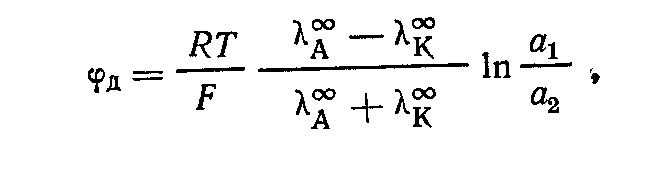
где  — предельные подвижности ионов. — предельные подвижности ионов.
Э. д. с. электрохимической цепи с учетом диффузионного потенциала будет
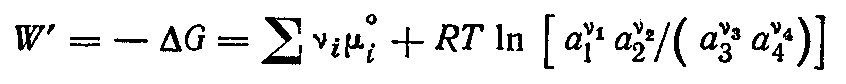
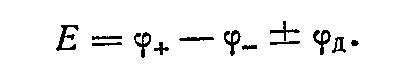
Поскольку расчет и экспериментальное определение диффузионного потенциала затруднены, то при измерениях э. д. с.  исключают, используя соленой мостик. Последний представляет собой концентрированный раствор электролита, подвижности ионов которого приблизитеьяо одинаковы (КСl, КNОз). Соленой мостик, например КСl, располагают между растворами цепи, и вместо одной жидкостной границы в системе имеются две. исключают, используя соленой мостик. Последний представляет собой концентрированный раствор электролита, подвижности ионов которого приблизитеьяо одинаковы (КСl, КNОз). Соленой мостик, например КСl, располагают между растворами цепи, и вместо одной жидкостной границы в системе имеются две.
35.Определение термодинамических характеристик обратимого гальванического элемента.
В электрохимических системах происходит взаимное превращение энергии химических реакций в электрическую энергию и обратно. Применение законов термодинамики к электрохимическим системам позволяет рассчитать значения равновесных электродных потенциалов и э. д. с. электрохимических цепей. Для обратимой реакции 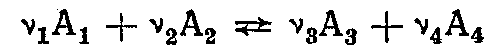
протекающей при постоянных давлении и температуре в электрохимической цепи, максимальная полезная работа выражается уравнением и соответствует электрической работе при э. д. с. цепи Е, равной zFЕ. Отсюда

где z— количество электронов, участвующих в электродных реакциях (одинаковое для обоих электродов);
F — число Фарадея.
Если активность каждого участвующего в реакции вещества равна 1, то э. д. с. цепи называется стандартной и равна 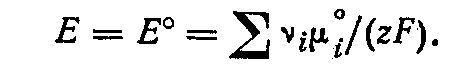
В соответствии с этим уравнение принимает вид
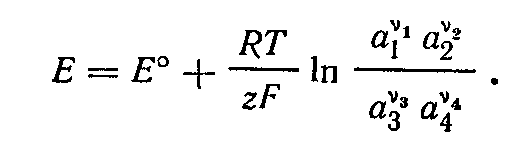
Обозначив  получаем получаем

Из уравнения изотермьг химической реакции следует 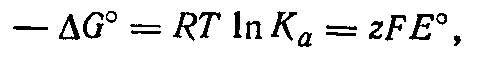
где Ка — константа равновесия реакции (Ка = К°). Отсюда
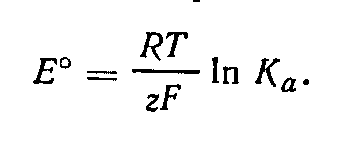
Связь между э. д. с. электрохимической цепи и изменением энтальпии протекающей в ней реакции устанавливается на основании уравнения Гельмгольца — Гиббса
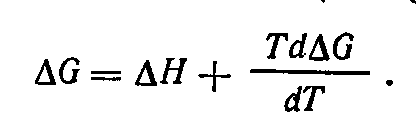
Убыль энергии Гиббса соответствует максимальной полезной (электрической) работе цепи:
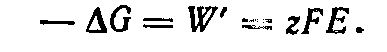


Из определения энергии Гиббса следует 
Сравнивая уравнения получаем 
Из уравнения видно, что электрическая работа цепи в общем случае не соответствует тепловому эффекту реакции. Если 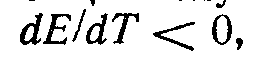 , то электрическая работа меньше энергии химического процесса, электрохимическая система отдает теплоту в окружающую среду или нагревается в условиях тепловой изоляции. При , то электрическая работа меньше энергии химического процесса, электрохимическая система отдает теплоту в окружающую среду или нагревается в условиях тепловой изоляции. При  электрическая работа системы больше энергии химической реакции; недостаток энергии система заимствует из окружающей среды или охлаждается в условиях тепловой изоляции. электрическая работа системы больше энергии химической реакции; недостаток энергии система заимствует из окружающей среды или охлаждается в условиях тепловой изоляции.
36(1).Электроды 1 и 2 рода, окислительно-восстановительный, сравнения.
Электроды первого рода. В потенциалопределяющих реакциях на этих электродах участвует один вид ионов. Металлические электроды, обратимые относительно катионов (в том числе и амальгамные), и металлоидные, обратимые относительно анионов:

Уравнение потенциалопределяющей реакции на электродах, обратимых относительно катионов, 
Электродный потенциал с учетом того, что активность твердого вещества при данной температуре постоянна и равна единице: 
А м а л ь г а м н ы е электроды состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла:  Уравнения потенциалопределяющей реакции электрода и его потенциала: Уравнения потенциалопределяющей реакции электрода и его потенциала: 

К электродам первого рода относятся также газовые.
Водородный электрод пластинка из платины, покрытая электролитической платиновой чернью, погруженной в раствор, содержащий потенциалопределяющие вещества, через который пропускается водород. В кислой среде системе  отвечает уравнение потенциалопределяющей реакции отвечает уравнение потенциалопределяющей реакции  которое может быть записано в упрощенном виде: которое может быть записано в упрощенном виде: 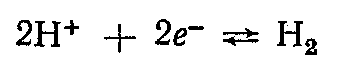
Потенциал водородного электрода 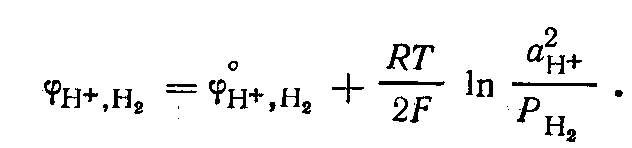
Поскольку стандартный потенциал водородного электрода при всех температурах условно принят равным нулю, то при Р, = 1 потенциал электрода определяется рН раствора: 
В щелочной среде в системе  протекает потенциалопределяющая реакция по уравнению протекает потенциалопределяющая реакция по уравнению 
которому отвечает уравнение для расчета потенциала: 
Водородный электрод применяется как индикаторный при экспериментальном определении рН растворов.
Кислородный электрод по устройству аналогичен водородному электроду. В щелочной среде для системы  электродный процесс и отвечающее ему уравнение для расчета потенциала электродный процесс и отвечающее ему уравнение для расчета потенциала 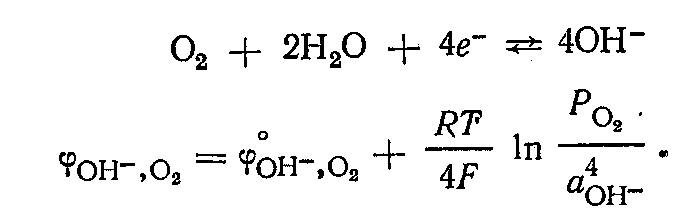
Создать практически кислородный электрод с данной реакцией не удается, так как в реальных условиях металлы под действием кислорода окисляютсяэПотенциал Кислородного электрода как в щелочной, так и кислой среде зависит от рН раствора: 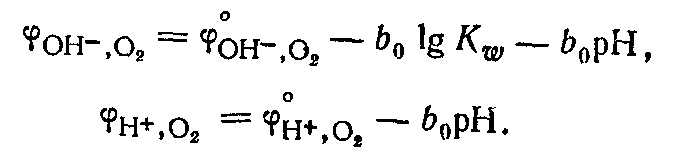
Электроды второго рода.
 Такие электроды состоят из трех фаз: Такие электроды состоят из трех фаз:
металл покрыт слоем его труднорастворимой соли и погружен в раствор, содержащий анионы, одноименные с анионами соли:
В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Электрохимическому процессу 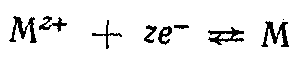 сопутствует химическая реакция, приводящая к осаждению или растворению МА: сопутствует химическая реакция, приводящая к осаждению или растворению МА:  Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона, Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона,

Последней реакции соответствует уравнение для расчета электродного потенциала 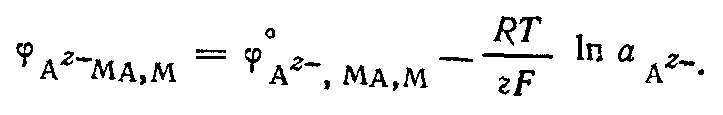
Электрод второго рода можно рассматривать как электрод первого рода, обратимый относительно катиона у которого активтность в растворе определяется растворимостью МА. Вследствие устойчивости потенциалов электроды второго рода могут быть использованы как электроды сравнения при потенциометрических измерениях. для этого наиболее употребительны каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из ртути, покрытой пастой, содержащей каломель, и соприкасающейся с раствором хлорида калия:  . .
Уравнение потенциалопределяющей реакции 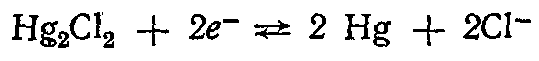
По концентрации применяемого раствора КСI различают 0,1 н., 1 н. и насыщенный каломельные электроды. Последний имеет наиболее широкое применение.
Хлорсеребряный электрод серебряная пластинка, покрытая АgС1 и погруженная в раствор КСI. Уравнение электродной реакции 
Окислительно-восстановительные электроды. Все электроды, которым соответствует потенциалопределяющие реакции с участием электронов, представляют собой окислительно-восстановительные системы. Однако принято в особую группу выделять электроды, в потенциалопределяющих реакциях которых не участвуют простые вещества — газы, металлы. Эти электроды называются окислительновосстановительяыми (редокси-электроды). В общем виде схема электрода и уравнение потенциалопределяющей реакции записываются так:

Сюда относятся в первую очередь электроды, у которых Ох и Red представляют собой ионы, причем электродная реакция состоит в перемене их заряда. Потенциал окислительно-восстановительного электрода для систем, характеризующихся равновесием  , потенциал рассчитывается по уравнению , потенциал рассчитывается по уравнению  Кроме относительно простых окислительно-восстановительных электродов существуют более сложные, в потенциал- определяющих реакциях которых участвуют ионы Н+ и молекулы воды. Например, системе Кроме относительно простых окислительно-восстановительных электродов существуют более сложные, в потенциал- определяющих реакциях которых участвуют ионы Н+ и молекулы воды. Например, системе  отвечают уравнения электродной реакции и для расчета потенциала электрода: отвечают уравнения электродной реакции и для расчета потенциала электрода: 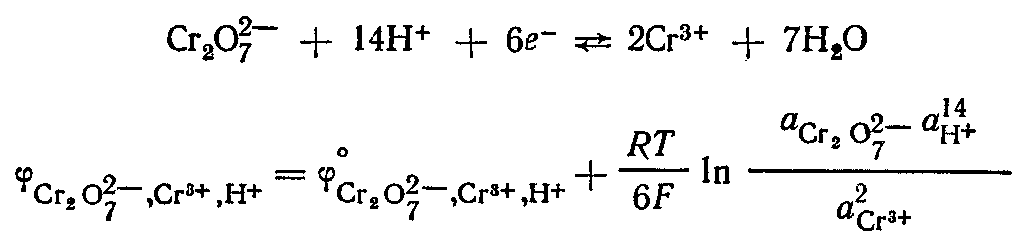
Из расчетного уравнения видно, что потенциал редокс электрода зависит от активности ионов Н+ в растворе. При условиях, обеспечивающих постоянство активностей других компонентов потенциалопределяющей реакции, такие окислительно-восстановятельньие электроды могут быть использованы как индикаторные при потенциометрическом определении рН растворов (например, хингидронный электрод).
Стеклянный электрод представляет собой тонкую мембрану из специального стекла, в котором повышено содержание щелочных составляющих соединений натрия, лития и др.Согласно теории Б. П. Никольского потенциалопределяющий процесс на границе раствор — стекло заключается в обмене между ионами щелочного металла, например Na+, содержащимися в cтекле, и ионами Н+, находящимися в растворе.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|




