|
Этап 3 — клеточная дисфункция и последствия токсичности
Взаимодействие с молекулой-мишенью может приводить к нарушению функций клетки —
этап 3 в развитии токсического эффекта (рис. 3-8). Каждая клетка в многоклеточном орга-
низме участвует в определенных процессах, контролируемых соответствующими системами
организма. Одни программы обеспечивают клеточное деление, дифференцирование и апоптоз,
другие — управляют функциональной деятельностью дифференцированных клеток. Регулиро-
вание работы клетки осуществляется с помощью СТС (см. выше), которая может быть активи-
рована и инактивирована внешними сигнальными молекулами.
Первичная клеточная дисфункция, вызванная токсикантом, — не обязательно окончатель-
ный результат, все зависит от функции молекулы-мишени (см. рис. 3-8). Если молекула-ми-
шень участвует в клеточной регуляции (передаче сигналов), прежде всего происходит дисре-
гуляция экспрессии генов и/или дисрегуляция выполняемой клеткой функции. Однако если
молекула-мишень вовлечена в процессы клеточного жизнеобеспечения, ее повреждение может
привести к гибели клетки. Воздействие токсиканта на внутриклеточные структуры, обеспечи-
вающие выполнение внешних функций клетки, может изменить активность других клеток.

Нарушение регуляции клеточных функций. Деятельность клеток регулируется сигнальными
молекулами, которые активируют определенные клеточные рецепторы. Последние передают
сигнал регуляторным областям генов и/или функциональным белкам. Таким образом, актива-
ция рецептора может привести к изменению экспрессии гена и/или химической модификации
определенных белков (обычно путем фосфорилирования). Программы, управляющие жизнью
клеток, прежде всего затрагивают экспрессию генов. Программы, контролирующие функции
клеток, влияют на деятельность функциональных белков; однако один сигнал часто вызывает
оба ответа из-за переходов и взаимосвязи сетей передачи сигналов.
Дисрегуляция генной экспрессии происходит при воздействии на структуры, принимающие
участие в транскрипции, передаче сигналов, синтезе, хранении или выделении экстрацеллю-
лярных сигнальных веществ.
Нарушение регуляции транскрипции. Транскрипция, представляющая собой передачу генети-
ческой информации от ДНК к мРНК, управляется взаимодействием факторов транскрипции
(TFs) и промоторных участков гена. Токсиканты могут нарушать этот процесс. Обычно пов-
реждаются TFs, в связывании и активации которых участвуют природные соединения, напри-
мер гормоны и витамины. Биогенный или чужеродный лиганд может оказывать токсический
эффект в двух случаях — при воздействии в больших дозах и/или в определенные периоды
онтогенеза. Другие вещества, взаимодействующие с TFs, могут нарушать дифференцировку
клеток за счет усиления экспрессии различных генов.
Нарушение процессов передачи сигнала. Экстрацеллюлярные сигнальные молекулы (факто-
ры роста, цитокины, гормоны и нейротрансмиттеры) могут в конечном счете активировать
TFs, воздействуя на мембранные рецепторы и/или внутриклеточную систему передачи сигнала.
На рис. 3-9 показаны такая система и активированные TFs, контролирующие транскрипцию
гена, ответственного за клеточный цикл. Примером может служить кодируемый с-тус протоон-
когеном с-Мус-белок — фактор транскрипции, который способен как активировать, так и реп-
рессировать транскрипцию генов. с-Мус-белок после димеризации с Мах-белком и связывания
комплекса с определенной нуклеотидной последовательностью, активирует гены циклинов D и
Е. Последние в свою очередь ускоряют деление клетки, активируя циклинзависимые киназы.
Синтезированные при этом сигнальные молекулы ускоряют клеточную пролиферацию. Сигнал
от мембранных рецепторов до TFs передается последовательным взаимодействием белок—бе-
лок и изменением конформации белка при фосфорилировании, т.е. сигнальная молекула вы-
зывает фосфорилирование белка, например митогенактивируемой киназы (MARK), которая в
свою очередь фосфорилирует и активирует другой белок. Например, лиганды к мембранным
рецепторам фактора роста (см. рис. 3-9, объект 6) запускают процесс аутофосфорилирования
этих рецепторов. Затем уже фосфорилированные рецепторы передают сигнал на Ras (G-бе-
лок). Активный Ras инициирует каскад MARK, запуская последовательное фосфорилирование
белков киназами и передавая сигнал на TFs. Передаточные молекулы обычно, но не всегда ак-
тивируются фосфорилированием (катализируется киназами) и инактивируются дефосфорили-
рованием (катализируется фосфатазами). Химические агенты могут нарушать (прекращать или
извращать) передачу сигнала путем повреждения структур, участвующих в фосфорилировании
(например, G-белков), и в конечном счете влиять на клеточный цикл.
В центре рис. 3-9 показан путь передачи сигнала от рецепторов факторов роста эпидермаль-
ного — EGF (6), которые действуют на тирозинкиназные рецепторы. Промежуточные белки —
She, Grb2, SOS — не показаны. Эти белки превращают ГДФ-связанный Ras (G-белок, неак-
тивный) в активную ГТФ-форму. Последняя активирует MAR-киназный каскад (Raf, MARKK,
MARK). Он состоит из трех протеинкиназ. Протеинкиназы — ферменты, способные катализи-
ровать реакцию присоединения фосфата к остатку серина, треонина или тирозина в молекуле
белка, образуя фосфорилированную форму белка. При этом меняется конформация молекулы
белка, белок активируется или ингибируется. По-видимому, фосфорилирование — это один из
главных способов регуляции внутриклеточных процессов, и в первую очередь регуляции про-
цессов считывания генетической информации (по разным оценкам, существует от 2000 до 10 ООО
разных протеинкиназ). Последняя стадия изображенного на рис. 3-9 MAR-каскада — образование
активной киназы, называемой MAR-киназой (MARK). Этот фермент фосфорилирует и тем
самым меняет активность нескольких белков-мишеней. MARK становится активной киназой
только после того, как к ней будет присоединен фосфат. Для того чтобы активировать MARK,
в клетке существует другая (специализированная) киназа, которая умеет фосфорилировать
только MARK— это киназа MARK (MARKK). Исходно этот фермент неактивен, как и MARK,
и в свою очередь тоже активируется присоединением фосфата. Для этого в клетке существует
еще одна протеинкиназа — Raf (киназа киназы MAR-киназы). Она исходно тоже неактивна,
но ее активирует Ras, получивший сигнал извне и проходящий через цепочку внутриклеточной
сигнализации, связанную со вторичными мессенджерами.

Фосфорилированная MARK переходит в ядро и фосфорилирует факторы транскрипции,
таким образом позволяя им связаться со специфическими последовательностями промотора.
Между всеми сигнальными системами существует взаимосвязь. Для передачи митогенного
сигнала от рецепторов 4, 5, 7 используется тот же путь передачи— рецептор EGF (6) — MARK.
Например, рецептор 4 передает сигнал через р\ у-субъединицы G-белка и тирозинкиназу Src;
интегриновый рецептор 5 — его лигандами являются компоненты внеклеточного матрикса
ЕСМ — скорее всего передает сигнал через G-белок Rho (не показан) и киназу местной адге-
зии (FAK). G-белок — интегрированный рецептор 7 — катализирует синтез вторичных мессен-
джеров через фосфолипазу С (PLC) и приводит к активации протеинкиназы С (РКС). Мито-
генный сигнал, переданный через рецептор EGF (6), — MARK может быть усилен, например
Raf-катализируемым фосфорилированием белка IkB, который отщепляет транскрипционный
фактор NF-kB от ингибирующего белка.
NF-kB — транскрипционный фактор — может активироваться АФК, введением в клетку
фенобарбитала или пролифераторов пероксисом. Активация происходит опосредованно через
Ras-Raf-MARKK-MARK сигнальный путь.
Рецептор ростовых факторов — белка фактора роста трансформирующего р (трансформи-
рующего ростового фактора р) — TGF -p (9) активирует путем фосфорилирования цитоплазма-
тические медиаторы белки Smad. Smad — группа родственных внутриклеточных белков, пере-
дающих сигнал в ядро от сверхсемейства TGF -p. Smad блокирует клеточный цикл, прерывая
путь передачи сигнала. MARK-катализируемым фосфорилированием Smad митогенный сигнал
можно усилить (рис. 3-9).
Митогенный сигнал появляется также при активации протеинкиназ (РКС, СаМК, MARK)
ионами кальция. Некоторые ксенобиотики способны блокировать проведение сигнала. Часть
из них может стимулировать пролиферацию (активация митогенных протеинкиназ, например
РКС, инактивация фосфатаз РТР, РР2А, инактивация GAP, IkB). Другая часть, например ин-
гибиторы РКС, препятствуют митозу и вызывают апоптоз.
Эта схема упрощена. Фактически все компоненты системы передачи сигналов (например,
G -белков, РКС, MARK) присутствуют в многочисленных, функционально различных формах,
характерных только для определенных клеток. Надо помнить, что системы, участвующие в
регуляции экспрессии генов, определяют не только жизненный цикл клеток, но также управ-
ляют некоторыми процессами клеточной деятельности. Например, NF -kB стимулирует синтез
белков острой фазы (БОФ).
Химически измененная передача сигнала с пролиферативным эффектом. Ксенобиотики, об-
легчающие фосфорилирование элементов цепи передачи сигнала, часто провоцируют усиле-
ние клеточного деления и формирование опухоли. Эфиры форбола и фумонизин В активи-
руют протеинкиназу С (ПКС, РКС), подражая диацилглицеролу (ДАГ, DAG) — одному из
физиологических активаторов РКС (см. рис. 3-9). Ионы двухвалентного свинца имитируют
действие другого физиологического активатора РКС — Са2+. Активированная РКС передает
сигнал далее, запуская киназный каскад и в конце концов позволяя факторам транскрипции
связаться с участками ДНК. Протеинкиназы могут также активироваться поврежденными
белками. Усиление фосфорилирования белков может быть результатом сниженной актив-
ности фосфатаз. Вероятно, ингибирование фосфатаз является основным механизмом дейс-
твия некоторых химических агентов. Оно происходит и при ультрафиолетовом облучении.
Растворимая фосфатаза 2А (РР2А), по-видимому, отвечает за инактивацию MARK. РР2А де-
фосфорилирует митозинициирующую протеинкиназу. Существуют и другие ингибирующие
ферменты, например ингибиторный белок IkB, гомологичный структурному белку анкирину,
связывается с NF-kB и предотвращает его проникновение в ядро (блокирование функции
фактора транскрипции).
NF -kB (NF -kappaB) является уникальным среди транскрипционных регуляторных белков.
Он играет роль внутриклеточного медиатора большого количества внешних воздействий в
некоторых типах клеток. Этот цитоплазматический фактор транскрипции уникален тем, что
может активироваться большим числом внутриклеточных путей, индуцируемых воспалитель-
ными цитокинами, окисленными липидами, факторами, присутствующими в атероматозных
бляшках, и запускать быструю активацию множества генов. NF -kB — важный интегрирующий
инструмент клетки. Комбинаторное использование его разных субъединиц приводит к воз-
можности дифференциальной регуляции множества генов с различными функциями в разных
типах клеток в разное время. Все эти белки работают в клетке как ДНК-связывающие транс-
крипционные факторы, активность которых регулируется в значительной степени на уровне
локализации в клетке. MARK могут регулировать транскрипцию, фосфорилируя ингибиторы
факторов транскрипции. В случае NF -kB как раз и осуществляется подобная регуляция. NF -kB
находится в цитоплазме в виде комплекса с одним из членов семейства ингибиторных белков
I-kB и удерживается в цитоплазме этим ингибитором за счет белок-белковых взаимодействий.
Роль ингибитора состоит в том, что он маскирует сигнал ядерной локализации фактора. Инги-
битор фосфорилирован, но при получении сигнала он фосфорилируется интенсивнее и затем
деградирует. Неизвестно, какие именно из киназ осуществляют фосфорилирование в ответ на
внеклеточные сигналы. Положение осложняется тем, что есть несколько родственных ингиби-
торов и, возможно, разные ингибиторы фосфорилируются разными киназами. Но как бы там
ни было, фактор NF -kB освобождается и направляется в ядро, где взаимодействует со специ-
фическими последовательностями в регуляторных участках генов и активирует транскрипцию
определенных групп генов.
VF-кВ является важным фактором пролиферации и передачи сигналов пролиферации при
воспалении и реакциях острой фазы. IkB-деградация и NF-кВ-активация также могут быть
вызваны кислородным голоданием.
Химически нарушенная передача сигнала с антипролиферативным эффектом. Падение интен-
сивности сигнала пролиферации (последовательность: ингибирование Raf белков — уменьшение
деградации IkB — угнетение процесса связывания NF-kB с ДНК — снижение интенсивности
синтеза белка с-Мус мРНК), возникающего после повреждения клеток, ставит под угрозу про-
цесс регенерации (рис. 3-9). Нарушение регуляции митогенного сигнала — путь к апоптозу.
Нарушение регуляции синтеза внеклеточных сигнальных веществ. Гормоны передней доли
гипофиза активируют деление и пролиферацию клеток в эндокринных железах. Снижение
уровня секреции гормонов гипофиза приводит к развитию дегенеративных процессов в пери-
ферических железах и апоптозу.
Нарушение регуляции клеточной активности. Токсиканты могут изменять функции специа-
лизированных клеток путем нарушения любого этапа передачи сигнала.
Нарушение регуляции процессов передачи сигналов в электрически активных клетках. Многие
ксенобиотики влияют на деятельность нейронов, клеток скелетной и сердечной мускулатуры.
11ойротрансмиттеры (нейромедиаторы) — химические соединения, которые служат средством
передачи информации от нейрона к другим клеткам: другому нейрону, мышечной клетке,
клетке железы или другим видам клеток. Содержание информации, передаваемой нейротранс-
миттером, различно. Это может быть управляющая информация, информация о состоянии
объекта управления, информация о результатах управления. Все виды информации необхо-
димы для структурно-функциональной организации элементов субклеточных систем, клеток,
тканей, органов, систем органов. Химические агенты, влияющие на процессы передачи нервно-
мышечного импульса, представлены в табл. 3-1. Токсиканты могут изменять концентрацию
нейротрансмиттеров, нарушать функции рецепторов, повреждать процессы внутриклеточной
передачи сигналов. Некоторые вещества способны изменять содержание нейротрансмиттеров
в синапсах, вмешиваясь в процессы их синтеза, хранения, экскреции и элиминации. Токси-
канты воздействиют на рецепторы как агонисты (вещества, имитирующие действие нейро-
трансмиттера), антагонисты (вещества, препятствующие активации рецепторов), активаторы
или ингибиторы (последние два вида воздействуют на участки рецептора, удаленные от зоны
связывания с лигандом). Агонисты и активаторы подражают физиологическому действию эн-
догенных лигандов, а антагонисты блокируют его. Многие вещества изменяют нейрональную
и/или мышечную активность за счет воздействия на процессы передачи сигнала. Некоторые
токсиканты способны активировать (инактивировать) потенциалзависимые натриевые каналы
(см. табл. 3-1).
Сигнал в клетке формируется за счет изменения тока катионов; удаление их посредством
ионных каналов или транспортеров приводит к терминации сигнала. Ингибирование ионных
каналов и транспортеров может продлевать эффекты веществ. Токсиканты могут нарушать
процесс терминации сигнала.
Многие изученные механизмы регуляции реализуются и в слабовозбудимых клетках (экзо-
кринных железах, клетках Купера, р-клетках поджелудочной железы). Повреждение механиз-
мов регуляции в таких клетках мало влияет на функции органов.
Повреждение процессов внутриклеточного жизнеобеспечения: механизмы токсической клеточ-
ной смерти. Для выживания все клетки должны синтезировать эндогенные молекулы, собирать
макромолекулярные комплексы, мембраны и клеточные органеллы, поддерживать постоянство
внутренней среды, производить энергию. Агенты, повреждающие эти процессы, ставят под угрозу
само существование клетки. Существуют 3 механизма инициирования клеточной смерти — ис-
тощение запасов АТФ, устойчивое повышение концентрации ионов кальция и избыточная
продукция АФК (ROS).
Истощение запасов АТФ. АТФ играет центральную роль в жизнеобеспечении клетки, ис-
пользуется и как субстрат для биосинтеза, и как главный источник энергии. АТФ необходим
для синтеза нуклеиновых кислот, процесса мышечных сокращений, энергетического обеспе-
чения и деления клеток. АТФ осуществляет деятельность ионных транспортеров. Химическая
энергия высвобождается при гидролизе АТФ до АДФ или АМФ. АДФ рефосфорилируется в
митохондриях АТФ-синтетазой.

Многие токсиканты нарушают этот процесс, называемый окислительным фосфорилиро-
ванием (табл. 3-2). Вещества класса А вмешиваются в процесс транспорта ионов водорода
по цепи передачи электронов. Вещества класса Б блокируют передачу электронов к атомам
кислорода. Класс В — ингибиторы транспорта кислорода к последнему в цепи переносчику
электронов — цитохромоксидазе. Класс Г — ингибиторы АТФ-синтетазы, ключевого фермен-
та окислительного фосфорилирования. Синтез АТФ может ингибироваться в случае прямого
ингибирования АТФ-синтетазы, нарушения доставки неорганического фосфата АДФ, прекра-
щения потока протонов. Класс Д — вещества, разрушающие митохондриальную ДНК.
Повышение уровня внутриклеточного кальция. Плазменная мембрана непроницаема для ио-
нов кальция. Концентрация кальция регулируется активностью транспортных систем. С их
помощью ионы кальция перекачиваются в эндоплазматический ретикулум (см. гл. 4) и мито-
хондрии.
Токсиканты увеличивают уровень цитоплазматического кальция путем усиления потока
кальция внутрь клетки и/или ослабления потока из клетки. Открытие лиганд- или потенци-
алзависимых кальциевых каналов или повреждение плазменной мембраны приводит к тому,
что в клетку по градиенту концентрации из внеклеточного пространства устремляется кальций.
Увеличение уровня может происходить также при выкачивании кальция из эндоплазмати-
ческого ретикулума и митохондрий. Повышенное содержание кальция оказывает токсическое
действие на клетку — проявляющееся истощением энергетических запасов (ингибирование
АТФазы), дисфункцией микрофиламентов и микронитей (цитоскелет), активацией гидролити-
ческих ферментов и генерацией АФК.
Из-за высокого уровня цитоплазматического кальция усиливается поток ионов внутрь
митохондрий. В результате отрицательный потенциал мембраны митохондрий исчезает, что
приводит к остановке процесса синтеза АТФ. Кроме того, химические агенты, окисляющие
NADH, активируют транспортер, выкачивающий кальций из матрикса. Повышенный уровень
цитоплазматического кальция повреждает микрофиламенты. Происходит разрушение актино-
вых нитей. От них отделяются нити а-актинина и фодрина, ответственные за прикрепление
микрофиламентов к плазменной мембране. В результате в мембране появляются разрывы.
Высокий уровень ионов кальция приводит к активации гидролитических ферментов, разру-
шающих белки, фосфолипиды и нуклеиновые кислоты. В частности, кальцийактивируемые
нейтральные протеазы разрушают встроенные мембранные белки. Неизбирательная активация
фосфолипаз ионами кальция приводит к повреждению клеточной мембраны, одновременно
происходит образование детергентов из фосфолипидов. Активация Са2+, М§2+-зависимых эн-
донуклеаз вызывает фрагментацию хроматина.
Многие ксенобиотики способны генерировать активные формы кислорода и азота (см. рис. 3-5).
Кальций активирует дегидрогеназы нитратного цикла, повышается скорость переноса электро-
нов, в результате чего увеличивается количество Oj и Н2Ог Активация NO-синтазы приводит
к синтезу ONOO.
Последствия нарушений метаболизма. Описанные ранее механизмы повреждения клеточных
структур могут взаимодействовать друг с другом и усиливаться.
• Истощение клеточных запасов АТФ приводит к остановке работы ионных насосов клеточной
мембраны и эндоплазматического ретикулума, что вызывает повышение уровня ионов каль-
ция. Усиливается поток кальция в митохондрии — исчезает разность потенциалов — бло-
кируется синтез АТФ.
• Гиперкальциемия облегчает образование АФК, что в свою очередь инактивирует кальциевые
насосы, тем самым усиливая гиперкальциемию.
• АФК также могут истощать запасы АТФ. NO+ — катион нитрония (производное NO") инак-
тивирует глицеральдегид-3-фосфатдегидрогеназу, ухудшает гликолиз, необратимо ингиби-
рует часть компонентов цепи переноса электронов.
• Кроме того, ONOO" может стимулировать одиночные разрывы цепей ДНК, активируя поли-
АДФ-рибозополимеразу (PARP). Этот фермент многократно переносит АДФ-рибозу с НАД+
на ядерные белки. В результате уменьшается количество НАД+, необходимое для синтеза
АТФ. Для ресинтеза НАД+ необходим АТФ. Недостаток НАД+ приводит к потенцированию
действия ONOO на ДНК.
Нарушение митохондриалъных процессов. Некроз. Приток ионов кальция в митохондрию сни-
жает абсолютное значение мембранного потенциала митохондрий, вызывает генерацию АФК,
разобщение метаболических процессов, регресс синтеза АТФ. Все эти факторы приводят к
увеличению проницаемости внутренней мембраны митохондрий (до размеров частиц 1500 Д).
Такие изменения обеспечивают переход протонов в матрикс митохондрии, полностью устра-
няя мембранный потенциал. Поврежденная митохондрия уже не способна синтезировать АТФ.
Но деполяризация мембран реверсирует АТФазу, и она начинает гидролизовать АТФ. Проис-
ходит бессмысленная трата энергии. Теперь под угрозу ставится сам процесс гликолиза, так
как для некоторых стадий необходим АТФ (гексокиназа, фосфофруктокиназа). Тотальное ис-
тощение энергетических запасов приводит к лизису или некрозу клетки (см. рис. 3-10).
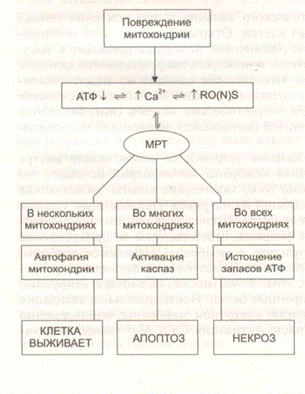
| Другой результат повреждения митохондрий: апоптоз. Химические агенты способны вызывать
апоптоз клеток. Некротизирующие клетки раздуваются и лопаются (лизируются), апоптизиру-
ющая клетка сжимается, уплотняется, ядерные и
цитоплазматические структуры конденсируются и
фрагментируются, образуя апоптотические тельца,
которые фаголизируются. Некроз клетки происхо-
дит по различным механизмам, описанным выше.
Апоптоз происходит в определенном порядке,
включающем каскад реакций катаболизма. Ко-
нечным этапом является полный распад клетки.
Апоптоз схематически представлен на рис. 3-11.
Чаще всего процесс гибели клетки под действи-
ем токсикантов связан с деградацией митохонд-
рий. Другой путь — выход в цитоплазму цитохрома
с (cyt с), гемсодержащего белка, который обычно
находится на поверхности внутренней мембраны в
митохондриальном межмембранном пространстве.
Cyt с — последний компонент ЦПЭ, его отсутст-
вие полностью блокирует синтез АТФ. Происхо-
Рис. 3-10. Схема повреждения клетки. MPT (mitochon-
drial permeability transition) — нарушение проницаемос-
ти митохондриальных мембран. RO(N)S — активные
формы кислорода и/или азота.
дит увеличение содержания Oj, и начинается процесс некроза. Одновременно свободный cyt
с является запускающим фактором апоптоза (см. рис. 3-11). Cyt с после соединения с АТФ и
специфическим белком может стимулировать протеолитический распад белков под действием
каспаз (цистеиновых протеаз). Некоторые каспазы (например, 2, 8 и 9) активируют прокаспа-
зы. Это ведет к активации так называемых эффекторных каспаз (например, 3, 6 и 7), которые
расщепляют определенные клеточные белки, активируя или инактивируя их.
Основные пути клеточной смерти — через повреждение митохондрий или запуск cyt с — кон-
тролируются семейством белков Вс1-2. Среди этих белков присутствуют те, которые облегчают
протекание процессов клеточной смерти, например Вах, Bad и Bid, и те, которые ингибируют
этот процесс, например Bcl-2, Bcl-xL. Соотношение антагонистических белков является «пе-
реключателем» между жизнью и смертью.
Проапоптические белки Вах и Bid являются инициаторами реакций апоптоза. Они запуска-
ют цепь реакций, ведущих к деградации структуры ДНК, через активацию мембранных рецеп-
торов семейства Fas (см. рис. 3-11). Повреждение ДНК вызывает стабилизацию и активацию
р53-белка, который усиливает синтез Вах-белка (проапоптотического белка), что в конечном
счете связано с риском появления мутаций и канцерогенеза (см. гл. 3.3).
Апоптоз является природным механизмом защиты. Возбуждение Fas-рецепторов может не-
посредственно активировать каспазы и вовлекать митохондрии в процесс разрушения клеточ-
ных структур — программа каспаззависимой активации Bid (см. рис. 3-11).
Таким образом, апоптоз реализуется разными путями, но везде участвуют каспазы. Реали-
зация апоптоза в каждом конкретном случае зависит от инициирующего фактора и состояния
клетки.
Наличие АТФ определяет форму клеточной смерти. Многие ксенобиотики могут вызывать и
апоптоз, и некроз. Апоптоз обычно индуцируется при воздействии низких концентраций ток-
сикантов, при высоких концентрациях развивается некроз. Исследования показали, что реша-
ющим фактором является количество свободного АТФ. Когда повреждается небольшая часть
митохондрий, они лизируются и процесс останавливается. Когда же происходит разрушение
значительной части митохондрий, механизм аутолиза не срабатывает, а высвобождающийся cyt
с запускает процесс активации каспаз и апоптоз (см. рис. 3-11). При вовлечении в процесс всех
митохондрий запасы АТФ полностью истощаются и процесс апоптоза не может запуститься
(для запуска необходима энергия). Происходит цитолиз.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|




