АБСОРБЦИЯ (РЕЗОРБЦИЯ) И РАСПРЕДЕЛЕНИЕ ТОКСИКАНТОВ
Абсорбция (резорбция) — процесс всасывания токсиканта из места поступления в систем-
ный лимфо- и кровоток. Если вещество оказывает повреждающее действие на месте введения
(поступления), то такое воздействие называют местным, например действие сильных кислот и
щелочей на кожу. Всасывание зависит от пути введения и растворимости токсиканта в тканях
в месте его введения, а также от скорости кровотока в этих тканях. При внутривенном или
внутриартериальном введении токсикант сразу и полностью попадает в кровоток.
Резорбция ксенобиотиков из мест поступления в кровь характеризуется коэффициентом
резорбции (крез), который определяется долей вещества, перешедшего в кровь из места введе-
ния.
По своим химическим и физико-химическим свойствам большое количество веществ спо-
собно как к местному, так и к резорбтивному, или системному действию.

На скорость и способ резорбциии (поступления) токсиканта в кровяное русло влияют мно-
гие факторы (табл. 4-5).
Энергозависимый трансмембранный транспорт очень многих токсикантов осуществляется
белками-переносчиками. Один из них — Р-гликопротеин — расположен на мембранах эпи-
телиальных клеток тонкой кишки, поверхности желчных канальцев печени, проксимальных
канальцах почек и эпителиальных клеток, входящих в состав гематоэнцефалического и гемато-
тестикулярного барьеров. Р-гликопротеин влияет на распределение ксенобиотиков за счет ог-
раничения их абсорбции в кишечнике, облегчая выделение путем секреции с желчью и мочой
и уменьшая их проникновение в головной мозг и яички.
Резорбция через кожу
Поступление веществ через кожу (см. гл. 2.4.5) осуществляется через эпидермис, сальные и
потовые железы или волосяные фолликулы путем пассивной диффузии. Резорбция веществ,
имеющих среднюю молекулярную массу и умеренно растворимых в воде, подчиняется уравне-
нию Фика.

Основные факторы, влияющие на скорость резорбции токсикантов через кожу, представле-
ны в табл. 4-6.
Резорбция через слизистые оболочки
Топография слизистых оболочек в организме человека разнообразна. Слизистые оболочки
выстилают внутренние органы, сообщающиеся с внешней средой (легкие, ЖКТ, влагалище и
др.), а также глаза. С поверхности слизистых оболочек, как и с поверхности кожи, происходят
всасывание токсикантов и их поступление в системный кровоток.
Многие токсиканты легко резорбируются слизистыми оболочками, которые покрыты вод-
ной или слизистой гидрофильной пленкой. Резорбтивная способность различных слизистых
оболочек во многом близка.
В табл. 4-7 представлены морфоанатомические особенности слизистых оболочек человека.
Скорость резорбции большинства токсикантов через слизистые оболочки пищеварительно-
го тракта во многом определяется их растворимостью в липидах и способностью к ионизации
при определенном рН среды. Некоторые токсиканты всасываются путем активного транспорта.
При введении токсикантов внутрь скорость их абсорбции в разных отделах ЖКТ различная.
Резорбция в ротовой полости
В хорошо снабжаемой кровью ротовой полости (рН среды 6,6—6,9) происходит быстрое
всасывание многих находящихся в молекулярной форме токсикантов, которые затем поступа-
ют в сердце, малый круг кровообращения и далее в общий кровоток. При резорбции в ротовой
полости токсиканты распределяются в организме, минуя печень.

Резорбция в желудке
Резорбция токсикантов в желудке (рН среды 0,9—2,0) происходит путем простой диффузии.
Липофильные вещества абсорбируются лучше, чем гидрофильные. Кислотность желудочного
содержимого определяет особенности всасывания токсикантов.
На рис. 4-10 приведены графики зависимости содержания (в процентах) в растворе 3 форм
салициловой кислоты: неионизированная (форма 1), ионизированной по карбоксильной группе
(форма 2) и ионизированной по карбоксильной и фенольной группам (форма 3) от рН среды.
Как видно на рисунке, при физиологических значениях рН желудочного сока салициловая
кислота присутствует в недиссоциированной и диссоциированной по карбоксильной группе
формах. Их концентрации примерно равны, хотя и могут быть изменены. В то же время в
плазме крови салициловая кислота может присутствовать исключительно во второй форме (см.
рис. 4-10). Третья форма вещества при физиологических значениях рН среды образоваться не
может. На рис. 4-11 приведены аналогичные кривые зависимости для морфина. Как видно
на рисунке, у морфина существует уже 5 форм. При физиологических значениях рН среды
желудка он присутствует исключительно в протонированной по азоту форме 3. На основании
этого факта можно сделать вывод о том, что морфин практически не должен резорбироваться
из желудка. Данный вывод отлично согласуется с практикой. Аналогичным образом ведет себя
большинство алкалоидов.
Как правило, натощак всасывание в желудке идет интенсивнее, так как взаимодействие
токсиканта с компонентами пищи снижает его концентрацию и соответственно скорость диф-
фузии в кровь. С другой стороны, прием пищи вызывает изменение рН содержимого желудка и
увеличивает время эвакуации из желудка, что сопровождается и повышением степени резорб-
ции ряда токсикантов.
Резорбция в кишечнике

Токсиканты всасываются в кровь преимущественно в кишечнике (рН среды тонкой
кишки 6,5, сока поджелудочной железы 8,6—9,0; сока тонкой кишки 5,07—7,07; толстой

кишки — 6,8), большая часть которых — путем пассивной диффузии, остальные — посредс-
твом активного транспорта. В кишечнике не резорбируются сильные кислоты и основания,
затруднено всасывание ионизированных молекул, содержащих четвертичный азот. Резорбция
слабых кислот определяется величиной их рКа. Важно отметить, что с увеличением концентра-
ции токсиканта в кишке повышается скорость его всасывания, но при этом сохраняется доля
(процент) всосавшегося вещества.
Если вещество нерастворимо в липидах, то оно практически не проникает из кишечника в
кровь. Нерастворимые в воде липофильные соединения также не резорбируются в кишечнике.
Размеры молекул влияют на резорбцию: чем больше молекулярная масса, тем труднее про-
никает вещество через эпителий кишечника.
Токсиканты резорбируются во всех отделах кишечника, что связано с его морфофункцио-
нальными особенностями. Наиболее высокая скорость всасывания наблюдается в тонкой киш-
ке (см. табл. 4-7).
В настоящее время активно изучается роль Р-гликопротеиновой системы клеточного пере-
носа, расположенной на поверхности эпителиальных клеток тонкой кишки. Установлено, что
Р-гликопротеин является выкачивающим насосом, способным переносить широкий спектр со-
единений из внутриклеточного пространства снова во внеклеточный матрикс и таким образом
снижать эффективное всасывание токсикантов. Например, если ввести лекарственный препа-
рат лоперамид, опиоид, который обычно не влияет на центральную нервную систему (ЦНС),
одновременно с квинидином (ингибитор Р-гликопротеина), то лоперамид вызывает побочные
эффекты со стороны ЦНС. В экспериментальных моделях на животных ингибировали Р-гли-
копротеин, вводили различные лекарственные средства и определяли их концентрации. При
этом концентрация препаратов повышалась в 10—100 раз по сравнению с контрольной группой
(Lin и Yamazaki, 2003).
В толстой кишке скорость резорбции ниже, так как концентрация токсикантов меньше, чем
в вышерасположенных отделах кишечника (см. табл. 4-7).
Всасывание неорганических ионов зависит от их природы, величины заряда и ряда физико-хи-
мических свойств. Чтобы количественно охарактеризовать всасывание подобных токсикантов
из ЖКТ в кровь и лимфу, пользуются коэффициентом всасывания, или резорбции kpc]. Не-
всосавшаяся часть токсиканта через некоторое время удаляется из ЖКТ вместе с содержимым
и слизью, выстилающей стенки кишечника. крез равен отношению концентрации токсиканта,
всосавшегося в плазму крови и лимфу, к его исходной концентрации при условии однократ-
ного поступления в барьерный орган (ЖКТ).

Значения к установлены для большого количества элементов, попадающих в ЖКТ в ион-
ном виде.
Приведенные в табл. 4-9 уравнения позволяют расчетным путем получить ориентировочные
значения к неорганических веществ из ЖКТ в кровь.
Для веществ, поступающих через рот, время пребывания их в желудке замедляет резорбцию,
поэтому скорость перехода веществ из желудка в двенадцатиперстную кишку имеет большое
значение. Например, холодные растворы токсикантов часто оказываются более токсичными,
чем теплые, так как быстрее покидают желудок.
На скорость и степень резорбции токсикантов на протяжении всего ЖКТ оказывают вли-
яние эндогенные соединения (ферменты, желчные кислоты, гормоны и др.), объем и состав
пищи (например, стимулирующее действие пищи на секрецию желудочного сока и соляной
кислоты), количество принятой жидкости, интервал между приемом пищи и введением
токсиканта, курение и прием алкоголя, микрофлора кишечника. Например, прием алкоголя и
курение способствуют увеличению резорбции свинца в кровь почти в 2 раза, лактобактерии,
энтерококки, клостридии кишечника деметилируют наркотик метамфетамин, у грудных детей
возможны восстановление нитратов до нитритов под действием микроорганизмов кишечника
и образование метгемоглобина (см. гл. 2.4.2).
При интерпретации результатов химико-токсикологического анализа различных токсикан-
тов (см. гл. 5, 7—11) учитывают феномен их печеночно-кишечной циркуляции, сущность кото-
рого заключается в следующем. Конъюгаты токсикантов с глюкуроновой кислотой (см. ниже)
плохо растворимы в жирах и хорошо — в воде, в связи с чем их резорбция в кишечнике затруд-
нена. При частичном гидролизе конъюгатов концентрация липофильных молекул агликона
(свободного токсиканта или его метаболита) вновь возрастает, и они обратно резорбируются
в кровоток.

Резорбция в легких
Через легкие в организм поступают газообразные (парообразные, летучие) токсиканты (см.
гл. 8.2), что нередко происходит не только в производственных и лабораторных условиях, но
и в быту, а также в связи с загрязнением окружающей среды или химическими и другими ка-
тастрофами (см. гл. 10 и 11). Поступление веществ при вдыхании их паров зависит от природы
токсиканта и ряда физиологических параметров альвеолярной вентиляции, остаточного объема
легких, проницаемости для данного вещества альвеолярно-капиллярной мембраны (барьера),
скорости легочного кровотока, минутного объема сердца, общего объема крови, массы легоч-
ной ткани и других показателей.
Процесс диффузии кислорода через альвеолярно-капиллярный барьер описывается уравне-
нием:
D = 0,5aD(S+Sy%1'2,
m ' /Л а с' '
где Dm — скорость диффузии (мл/мин) — абсорбционный коэффициент Бунзена; Dp — коэф-
фициент диффузии кислорода; Sa — площадь поверхности легочного эпителия; Sc — площадь
поверхности эндотелия альвеолярно-капиллярного барьера — средняя эффективная толщина
альвеолярно-капиллярного барьера.
Ингаляционно в организм могут поступать не только газы и пары, но и аэрозоли. Для ре-
зорбции токсикантов вдыхаемый газ должен вступить в контакт с альвеолярной поверхностью
легких (см. табл. 4-7). Альвеолы разделены тонкими соединительнотканными перегородками,
в которых проходят кровеносные капилляры. Базальная мембрана эндотелия капилляра может
вплотную приближаться к базальной мембране эпителия стенки альвеолы, благодаря чему барь-
ер между кровью и воздухом (аэрогематический барьер) оказывается очень тонким — 0,5 мкм.
Между альвеолами существуют сообщения в виде альвеолярных пор диаметром 10—15 мкм.
Альвеолы тесно прилежат друг к другу, и капилляры, оплетающие их, одной своей поверхностью
граничат с одной альвеолой, а другой — с соседней. Это обеспечивает оптимальные условия для
газообмена между кровью, протекающей по капиллярам, и воздухом, заполняющим полости аль-
веол. Однако путем простой диффузии газ не может быстро преодолеть расстояние от полости
носа или ротовой полости до стенок альвеол. Конвекция (механическое перемешивание газов
в дыхательных путях и легких) осуществляется за счет последовательно сменяющих друг друга
актов вдоха и выдоха (вентиляции легких), что обеспечивает постоянный обмен газами между
внешней средой и организмом. В среднем требуется около 2 мин, чтобы концентрацию газа в
альвеолах довести примерно до 95% исходной, поступившей с вдыхаемым воздухом.
Аэрозоли — дисперсные системы, состоящие из жидких или твердых частиц, находящихся
во взвешенном состоянии в газообразной среде (обычно в воздухе). К аэрозолям относятся
дымы, туманы, пыли, смог. Размеры частиц в аэрозолях составляют от 0,005 до 100 мкм, чаще
от 0,15 до 5 мкм. При ингаляции аэрозолей глубина их проникновения в дыхательные пути
зависит от размера частиц, мельчайшие из них достигают поверхности альвеол. Доля вещества,
задержанная в дыхательной системе, зависит от размера частиц, минутного объема и частоты
дыхания. Локализация частиц в дыхательном тракте также определяется их размерами.
Осаждение пылевых частиц в дыхательном тракте происходит в результате трех процессов:
инерционного осаждения, седиментации и диффузии.
Инерционное осаждение происходит преимущественно в носовой полости, носоглотке,
гортани и трахее. Воздух в этих отделах движется со сравнительно большой скоростью. При
резком изменении потока воздуха крупные частицы диаметром более 1 мкм продолжают дви-
жение и оседают на слизистых оболочках (см. табл. 4-7). Благодаря механизму инерционного
осаждения верхние дыхательные пути отфильтровывают частицы диаметром более 1 мкм.
Седиментация происходит в бронхиальном дереве, где воздух движется с меньшей скоро-
стью. Главной причиной осаждения частиц является действие силы тяжести. Осаждаются час-
тицы диаметром менее 1 мкм.
В легочных альвеолах, где скорость движения воздуха мала, оседают самые мелкие частицы
(диаметром 0,1 мкм и менее). Механизм осаждения обусловлен броуновским движением и
диффузией.
Дальнейшая судьба токсиканта определяется его природой и размером пылевых частиц.
Если вещество хорошо растворяется в жидкостях, выстилающих дыхательные пути, то основ-
ное место занимает резорбция токсиканта в кровеносное русло. Нерастворимые и малораство-
римые вещества, депонированные в верхних дыхательных путях, удаляются из них вместе со
слизью движением ворсинок реснитчатого эпителия.
Частицы, осевшие в альвеолярной части легочной ткани, либо захватываются фагоцитами,
либо переходят с клетками лимфатической жидкости в лимфатические узлы и там отлагаются.
Выделение пылевых частиц из лимфатических узлов происходит в течение нескольких лет.
Резорбция слизистой оболочки глаз
Контакт паров, аэрозолей или капель токсиканта со слизистой оболочкой глаза оказывает
как местное, так и системное действие. Например, взаимодействие паров зарина (фосфороор-
ганическое боевое отравляющее вещество) со слизистой оболочкой глаза не только вызывает
паралич мышц зрачка, потерю способности глаза к аккомодации и ослабление зрения, но и
ингибирует действие фермента холинэстеразы (см. гл. 8.4).
Скорость резорбции определяется природой вещества (растворимость в липидах и воде, за-
ряд молекулы, значение рКа, размер молекулы) и особенностями липидного барьера роговицы
глаза (см. табл. 4-7), через который легко проникают жиро- и водорастворимые вещества.
Токсикант, контактирующий с роговицей, равномерно распределяется по поверхности скле-
ры и конъюнктивы глаз. Часть его смывается слезной жидкостью, содержащей 1,5% хлорида
натрия, 0,5% альбумина и слизь, в состав которой входит лизоцим.
Токсикант задерживается на роговице от нескольких секунд до 6—10 мин, его максимальное
содержание в структурах глаза наблюдается в роговице, минимальное — в хрусталике. Склеро-
тические процессы (в том числе возрастные) в сосудистой системе глаза нарушают процессы
резорбции.
Резорбция из тканей
При подкожном и внутримышечном введении или через раневую поверхность токсикант
также может поступить в кровь. При подкожном введении токсикант попадает в подкожную
клетчатку, богатую жировой тканью (см. гл. 2.4.5), выступающей в качестве депо для ксенобио-
тика. Скорость резорбции и биодоступность токсиканта значительно меньше, чем при внутри-
мышечном введении, когда вещество вначале поступает в мышцу, накапливается в ней, а затем
резорбируется в кровь. В этом случае мышца служит депо для токсиканта.
Различия в концентрациях токсиканта в месте введения, окружающей ткани и крови явля-
ется условием резорбции вещества в кровь и внутренние среды организма. Сеть капилляров
и лимфатических сосудов хорошо развита в подкожной клетчатке и межмышечной соедини-
тельной ткани. Кровеносные капилляры — наиболее многочисленные и самые тонкие сосуды,
имеющие, однако, различный просвет. Наиболее узкие капилляры (диаметром 4,5—7 мкм)
находятся в поперечнополосатых мышцах, легких, нервах и т.д., более широкие (диаметром 7—
11 мкм) — в коже и слизистых оболочках. В мышце человека на I мм2 насчитывается 1400—2000
капилляров, а в коже на той же площади — 40. Пористость (диаметр пор 3—4 нм) и тонкость
стенок капилляров, огромная площадь их соприкосновения с тканями (более 6000 м2), мед-
ленный кровоток (0,5 мм/с), низкое артериальное давление (20—30 мм рт. ст.) обеспечивают
наилучшие условия для обменных процессов (см. гл. 2.4). Поверхность всасывания в тканях
для липофильных соединений в сотни раз больше, чем для водорастворимых веществ, прони-
кающих в кровь только через поры.
Резорбция токсиканта зависит и от процента функционирующих (раскрытых) капилляров
и давления крови в тканях, которое регулируется вазоактивными факторами (эндотелийзави-
симые релаксирующие факторы, оксид азота, простагландины, эндогенные регуляторы — ад-
реналин, норадреналин, ацетилхолин, серотонин). Мембрана капилляра проницаема для водо-
растворимых, а также и высокомолекулярных веществ, если размер их молекул не превышает
размера пор капилляра. Поэтому проникновение очень многих токсикантов в кровь вполне
возможно при их введении в мышцы.
Распределение токсикантов
Токсикант после поступления в кровь неравномерно распределяется кровотоком по органам
(тканям) и достигает клеток-мишеней, проявляя токсическое свойство (см. гл. 3). Накопление
токсиканта далеко не всегда происходит в органе(ткани)-мишени, что приводит к снижению
токсического эффекта.
Распределение — динамический процесс, включающий связывание с белками плазмы и фор-
менными элементами крови, проникновение (пенетрацию) в эфферентные органы (ткани),
поступление в метаболизирующие или экскретирующие органы, осуществляющие биотранс-
формацию токсикантов. Некоторые токсиканты избирательно накапливаются в том или ином
органе (ткани) или клетках определенного типа. Характер распределения токсикантов зависит
от ряда причин, в том числе и от генетически детерминированных индивидуальных особен-
ностей, что определяет вариацию токсикокинетических параметров и степень развития токси-
ческого эффекта.

Распределение токсикантов осуществляется посредством жидких сред (жидкостей) организ-
ма (табл. 4-10).

Скорость и характер распределения вещества в тканях определяется скоростью диффузии
вещества через соответствующие мембраны, скоростью перфузии (интенсивностью кровотока),
свойствами клеточных мембран, сродством токсикантов к молекулам-мишеням или другим хи-
мическим структурам, находящимся в клетках. В различных органах стенки капилляров имеют
различные свойства и, следовательно, различную проницаемость для химических веществ.

В табл. 4-11 приведены свойства, локализация различных барьеров и влияние, которые они
оказывают на проницаемость веществ.
Токсиканты распределяются в виде молекул и ионов, некоторые из них при физиологичес-
ком значении рН крови образуют коллоидные частицы, становясь третьей формой, которая
содержится в этой жидкости. Молекулы, ионы и коллоиды токсикантов могут переносится
кровью разными способами (см. гл. 7—11):
• физически или химически связываясь с элементами крови, главным образом с эритроци-
тами;
• физически растворяясь в плазме в свободном состоянии;
• связываясь с одним или более видом белков плазмы, образуя комплексы, либо прикрепля-
ясь к другим фракциям плазмы.
Для большинства токсикантов в крови наблюдается динамическое равновесие между
2 фракциями токсиканта, находящегося в свободном и связанном с белками плазмы или эрит-
роцитами крови состоянии.
Некоторые токсиканты переносятся элементами крови, прежде всего эритроцитами и, реже,
лейкоцитами. Внешняя поверхность мембраны эритроцитов имеет отрицательный заряд из-за
наличия молекул мукополисахаридов. Положительно заряженные ионы, особенно содержащие
четвертичный атом азота в молекуле, активно взаимодействуют с поверхностью эритроци-
тов. Токсиканты неорганической природы могут абсорбироваться поверхностью эритроцита
(например, мышьяк, цезий, торий, радон, свинец и натрий) либо связываться с лигандами
стромы. Попадая внутрь эритроцита, ксенобиотики могут взаимодействовать с гемом (монок-
сид углерода) или с глобином (2|° Ро) и накапливаться в силу этого преимущественно в крови
пострадавших. Один и тот же элемент в зависимости от степени окисления связывается по-
разному: ионы, содержащие Cr (VI), — исключительно с эритроцитами, а ионы Сг34, неспособ-
ны проникать через клеточные мембраны. Органические соединения ртути (например, метил-
ртуть) в основном связываются с эритроцитами, а ионы ртути переносятся преимущественно
альбумином плазмы. За перенос цинка конкурируют эритроциты, а также специфические и
неспецифические белки-переносчики (см. гл. 8.5). Газы и пары могут растворяться в плазме.
Большинство токсикантов переносятся белками плазмы. Плазма крови человека содержит
около 75 мг/мл белка (см. гл. 2.4.3) и представлена альбуминами (35—55 мг/мл), глобулинами
(иммуноглобулинами), белками свертывающей системы крови, белками системы комплемента,
ингибиторами протеолиза, липо- и гликопротеинами (0,9 мг/мл). Белки плазмы имеют общую
поверхность площадью 600—800 км2, способную абсорбировать токсиканты.
Альбумин обладает уникальной способностью связывать многие низкомолекулярные ток-
сиканты. Молекулярная масса альбумина около 66 000 Д, альбумин содержит 585 остатков
аминокислот, третичная структура белка поддерживается 17 дисульфидными связями, при
рН 7,4 находится преимущественно в анионной форме. Молекулы альбумина содержат около
109 катионных и 120 анионных участков для связывания ионов. Альбумин переносит, напри-
мер, ионизированные формы таких соединений, как динитро- и ортокреозолы, нитро- и гало-
генопроизводные ароматических углеводородов, барбитураты, витамин С, гистамин и многих
других соединений разных классов. Большинство попавших в кровь веществ фиксируется на
альбуминах независимо от того, являются они нейтральными, кислыми или основными соеди-
нениями.

На альбумине человека выделяют несколько связывающих участков (их число точно не ус-
тановлено, предполагают более 6). Центры связывания (табл. 4-12) отличаются друг от друга
сродством к веществам с различными рКа, механизмами взаимодействия с токсикантами, кон-
стантами устойчивости (нестойкости) комплекса белок—токсикант. Вещества, связывающиеся
с одним и тем же участком, могут конкурентно (согласно закону действующих масс) вытеснять
другие, что приводит к изменению их концентрации в плазме крови.
Достаточно часто встречается гипоальбуминемия, которая нарушает или изменяет транс-
порт токсикантов.
Молекулы а,-, а,-, р,-, (32-, у-глобулина переносят малые молекулы соединений (витамины
А, В|2 D, Е, К, стероидные гормоны и др.), ионы некоторых металлов (медь, цинк и железо)
и коллоидные частицы.
Липопротеины плазмы переносят липофильные токсиканты, такие, как полихлорирован-
ные дифенилы ПХБ (см. гл. 10). Гликопротеины связывают молекулы, обладающие свойства-
ми слабых оснований.
Органические кислоты (молочная, глутаминовая, лимонная) образуют комплексы с некото-
рыми токсикантами (например, катионами щелочно- и редкоземельных элементов), имеющи-
ми высокую степень диффузии.
Другие белки плазмы — трансферрин, металлотионин, церулоплазмин конкурируют с органичес-
кими кислотами за перенос катионов, образуя прочные специфические комплексы (см. гл. 8.5).
В зависимости от степени сосудистой (кровяной) перфузии организм человека можно раз-
делить на следующие компартменты в нисходящем порядке:
• внутренние органы, включая мозг (75% общего объема крови);
• кожа и мышцы;
• жировые ткани;
• соединительные ткани и кости (около 1% общего объема крови).
Хорошо перфузируемые внутренние органы обычно получают наивысшую концентрацию
токсикантов за короткое время. Поступление токсикантов в ткани с пониженной перфузией
происходит гораздо медленнее, однако степень их удерживания выше и период пребывания
(аккумуляция) более продолжительный.

В табл. 4-13 приведены особенности кровоснабжения различных органов и суммарная пло-
щадь их капиллярного русла.
Важнейшую роль в межклеточном распределении токсикантов играет содержание влаги,
липидов и белков в клетках различных тканей и органов. Указанный выше порядок ком-
партментов также довольно точно отражает содержание влаги в клетках этих компартментов.
Гидрофильные токсиканты более активно распределяются в жидкостях и клетках организма с
высоким содержанием влаги, а липофильные токсиканты — в клетках с повышенным содержа-
нием липидов (жировые ткани). Токсиканты из крови попадают в органы, богато снабжаемые
кровью, а затем они перераспределяются в соответствии с другими свойствами тканей, на-
пример наличием специальных механизмов захвата веществ, высоким содержанием структур,
связывающих ксенобиотик, или соотношением жира и воды в органе или ткани. Конечное
распределение токсикантов органической природы, длительно сохраняющихся в организме, не
зависит от особенностей кровоснабжения органов.
Высокомолекулярное водорастворимое вещество белковой природы (см. гл. 11), циркули-
рующее в крови, не диффундирует в ткани, если размер его молекулы превышает диаметр пор
стенки капилляров. Такое же — исключительно внутрисосудистое — распределение характерно
для комплексов низкомолекулярных веществ с белками плазмы крови. Процесс комплексооб-
разования токсиканта с белком подчиняется глобальному закону химии — закону действующих
масс. Поэтому по мере диффузии несвязанных молекул токсиканта происходит диссоциация
белковых комплексов до тех пор, пока концентрация свободного токсиканта не достигнет рав-
новесных значений во внутри- и внесосудистом пространстве.
Водорастворимые токсиканты, которые связываются с альбуминами и кислыми гликопроте-
инами, попадают в клетки лишь через поры клеточных мембран, диаметр которых значительно
меньше пор стенок капилляров (см. табл. 4-11). На способность веществ проникать через кле-
точные мембраны влияет величина рК,. Если изменяется кислотность плазмы крови (при ряде
заболеваний наблюдается алкалоз или ацидоз), то меняются соотношение ионизированной и не-
ионизированной форм молекул токсиканта и характер их распределения по тканям и органам.
Среди водорастворимых веществ есть и такие, которые проходят через стенки капилля-
ров, но не проникают внутрь клеток, накапливаясь в экстрацеллюлярном пространстве тканей
(сульфаты, тиоцианаты и др.).
Токсиканты, хорошо растворяющиеся в липидах, легко проникают не только через гисто-
гематические барьеры, но и через клеточные мембраны, попадают внутрь клеток и накапли-
ваются в жировой ткани (15—20% массы тела, у тучных людей 50% и более) и тканях, богатых
липидами (ЦНС), например пестициды, галогенопроизводные алифатических и ароматических
углеводородов и др. (см. гл. 7 и 8). Некоторые экополлютанты (см. гл. 10) и пестициды (ДДТ) —
практически нерастворимые в воде вещества — накапливаются в жирах, концентрация их в
крови незначительная, однако при снижении содержания жира в организме такие вещества
поступают из депо в кровь и оказывают токсическое действие.
Депонирование токсикантов (соединения свинца, кадмия, стронция, фтора и др.) возможно
в костной ткани (см. гл. 8) и связано с участием кристаллов гидроксиапатита и внеклеточной
жидкости, омывающей ее.
Депонирование — разновидность распределения токсикантов в организме, при котором про-
исходят его накопление и удерживание в определенном органе или ткани в течение некоторого
времени (от нескольких суток до многих лет) при относительно одинаковой концентрации.
Депонирование связано с высоким химическим сродством токсиканта к определенным эндо-
лигандам (химическим соединениям), содержащимся в депонирующей ткани, и/или высокой
липофильностью токсиканта.
Накопление токсиканта в конкретном компартменте обычно имеет временный характер, что
связано с различием между скоростью абсорбции и элиминации токсиканта. Нередко накоплению
токсиканта в ткани сопутствует его перераспределение в другие ткани, что часто определяется
функциональным состоянием органов, гормональным или микроэлементным дисбалансом, обес-
печенностью организма витаминами, приемом лекарственных средств и другими причинами.

Токсиканты, существующие в плазме крови в виде молекул, ионов, коллоидов, можно раз-
делить на несколько групп в соответствии с их преимущественным удерживанием и накопле-
нием в конкретном компартменте (табл. 4-14).
Барьерные функции — физиологические механизмы, которые обеспечивают защиту ор-
ганизма и отдельных его частей от изменений окружающей среды и сохранение необхо-
димого для нормальной жизнедеятельности постоянства состава, физико-химических и
биологических свойств внутренней среды (кровь, лимфа, тканевая жидкость). Например, про-
никновение в ЦНС водорастворимых ионизированных веществ крайне затруднено, что обус-
ловлено особенностями строения гистогематического барьера между кровью и тканью мозга —
гематоэнцефалического барьера и барьера, отделяющего цереброспинальную жидкость от кро-
вяного русла, — гематоликворного барьера.
Внутренние барьеры получили название тканевых, гематопаренхиматозных, сосудисто-тка-
невых и т.д. Наиболее распространен термин «гистогематический барьер». Особенностью гис-
тогематического барьера является его избирательная проницаемость. Большое значение для
жизнедеятельности организма имеют специализированные барьеры. К ним относят гематоэн-
цефалический барьер (между кровью и ЦНС), гематоофтальмический барьер (между кровью
и внутриглазной жидкостью), гематолабиринтный барьер (между кровью и эндолимфой лаби-
ринта), барьер между кровью и половыми железами. К гистогематическим барьерам относят
также барьеры между кровью и жидкими средами организма (цереброспинальной жидкостью,
лимфой, плевральной и синовиальной жидкостью) — так называемый гематоликворный, гема-
толимфатический, гематоплевральный, гематосиновиальный барьеры. Барьерными свойствами
обладает плацента.
Гематоэнцефалический барьер (ГЭБ) — барьер между кровью и мозгом (blood-brain barrier —
bbb). Капилляры мозга в отличие от всех других капилляров, имеют значительно меньший эф-
фективный радиус пор. Клетки эпителия в капиллярах плотно прилегают друг к другу. Мозг как
центральный орган охраняется особенно тщательно от проникновения большинства соедине-
ний. У питательных веществ, которые должны попасть в мозг (аминокислоты, пурины, глюкоза
и т.п.) есть специальные переносчики через мембраны эпителиальных клеток капилляров.
В табл. 4-15 приведена характеристика специализированных барьерных механизмов, пре-
пятствующих проникновению токсикантов в определенные ткани и органы.

Экзокринные железы. Токсиканты поступают в клетки желез путем диффузии через биологи-
ческие липидные пористые мембраны. Кислотность секрета желез отличается от кислотности
плазмы крови, например рН слюны и грудного молока ниже рН крови. Для этанола соотно-
шение содержания в грудном молоке и крови больше 1. Использование секретов экзокринных
желез в качестве биологического объекта для химико-токсикологического анализа (см. гл. 5)
объясняется прямой зависимостью между содержанием токсикантов в крови и секрете желез.

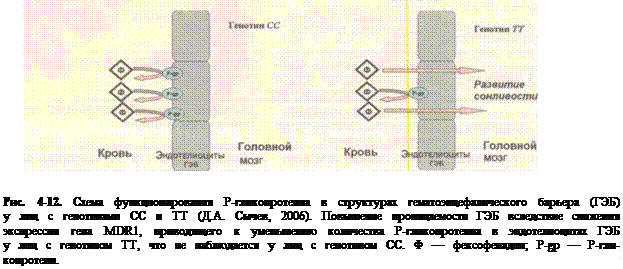
Токсикокинетические процессы находятся под генетическим контролем. В геноме человека
от 500 до 1200 различных генов ответственны за процессы биотрансформации. Индивидуаль-
ные генетические различия между людьми являются серьезным фактором, который следует
учитывать при интерпретации результатов химико-токсикологического анализа. Например,
оценивая концентрацию дигоксина в крови при подозрении на интоксикацию сердечными
гликозидами, следует иметь ввиду, что концентрация дигоксина достоверно выше у пациентов
с генотипом ТТ по сравнению с пациентами, имеющими генотипы СС и СТ, и это связано с
наличием полиморфного маркера С3435Т гена MDR1, экспрессирующего Р-гликопротеин.
Итак, липофильные токсиканты, проникнув в энтероциты, могут вновь «выбрасываться» в
просвет кишечника Р-гликопротеином. В энтероцитах, а затем и в гепатоцитах липофильные
токсиканты подвергаются биотрансформации до гидрофильных метаболитов, которые либо
попадают в системный кровоток, либо активно секретируются в желчь транспортерами орга-

нических анионов и катионов. Находясь в гепатоцитах, не успевшие метаболизироваться липо-
фильные лекарственные средства также способны активно секретироваться в желчь с помощью
Р-гликопротеина. Проникновение в ткани липофильных токсикантов затруднено функциони-
рованием Р-гликопротеина эндотелиоцитов кровеносных сосудов. Неметаболизировавшиеся
липофильные вещества способны активно секретироваться Р-гликопротеином в проксималь-
ных почечных канальцах в мочу.
БИОТРАНСФОРМАЦИЯ
Биотрансформация токсикантов, как правило, приводит к снижению их активности — дез-
активации (детоксикации). Однако в ряде случаев случаев метаболиты ксенобиотиков стано-
вятся, наоборот, более активными (активация) и даже более токсичными (токсификация), а
также могут изменить характер токсического действия или инициировать другой токсический
процесс (см. гл. 3). Биотрансформация — процесс превращения вещества в форму, удобную
для выведения из организма. Биотрансформация токсикантов — сложный многоплановый
процесс, в которы
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|




