|
ТОКСИКОКИНЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Токсикокинетика изучает качественные и количественные закономерности резорбции, распре-
деления, накопления ксенобиотиков в организме и выделения продуктов их катаболизма. Глав-
ной задачей токсикокинетики является установление, каким образом доза и способ воздействия
вещества на организм влияют на развитие токсического процесса. Появление и развитие этого
раздела токсикологии связаны с разработкой и внедрением в практику современных высокосе-
лективных и специфичных методов обнаружения и количественного определения токсикантов в
биологических средах. Достижения в разработке методов математического моделирования ток-
сикокинетических процессов оказывают серьезное влияние на развитие токсикокинетики. Зна-
ние и использование токсикокинетических характеристик вещества позволяет адекватно выбрать
органы и биологические жидкости, подлежащие химико-токсикологическому исследованию с
целью обнаружения токсиканта в организме, правильно интерпретировать результаты химико-
токсикологического анализа и решить ряд других важных вопросов, связанных с установлением
причины отравления, а также применить наиболее эффективный способ детоксикации и ле-
чения. Токсикокинетические исследования необходимы при разработке новых лекарственных
препаратов и форм, а также при проведении их клинических испытаний.
Биотрансформация ксенобиотиков — процесс превращения токсичных веществ в организме,
конечная цель которого сокращение времени воздействия ксенобиотиков.
Ответ метаболических структур и морфофункциональных комплексов организма на хими-
ческую агрессию носит кооперативный (суммарный) характер, что связано с флюктуациями,
вероятностью появления бифуркаций' и образования диссипативных систем2. Поэтому в ток-
сикологии так важно понятие о критических точках — пороговых, эффективных и среднесмер-
тельных дозах и концентрациях (см. гл. 2, 5—11, электронное приложение).
Организм — сложная гетерогенная система, состоящая из большого числа компартментов
(камер), разделенных биологическими барьерами. Например, под гистогематическими барь-
ерами понимают совокупность физиологических механизмов, регулирующих обменные про-
цессы между кровью и тканями и тем самым обеспечивающих постоянство состава и физико-
химических свойств тканевой жидкости, а также задерживающих переход в нее чужеродных
веществ из крови. Всасывание (абсорбция) — процесс поступления токсиканта из места вве-
дения в системный кровоток происходит при всех путях введения, кроме внутрисосудистого.
Молекулы или ионы токсикантов, поступая из окружающей среды, проникают в организм
через клеточные мембраны различных биологических систем, а также через сложную систему
эндомембран внутри клетки. Все токсикокинетические процессы происходят на молекулярно-
клеточном уровне, поэтому токсикокинетические характеристики вещества определяются не
только его природой, но и свойствами и функциями клеточных (внутриклеточных) мембран.
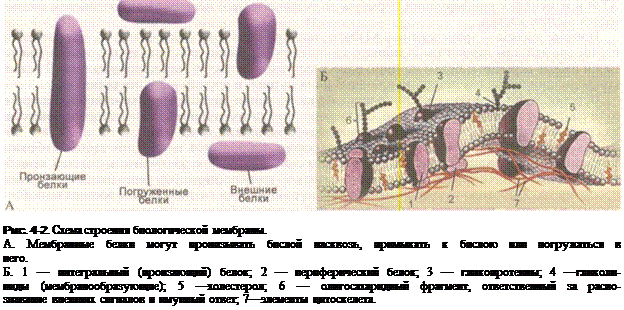
Цитоплазматическая мембрана клеток всех живых организмов построена одинаково. В на-
стоящее время наибольшим признанием пользуется жидкостно-мозаичная модель мембраны,
предложенная в 1972 году Сингером и Николсоном. Мембрана состоит из бислоя липидных
молекул. Молекулы белков встраиваются в слой липидов, располагаясь как на его внешней и
внутренней поверхности, так и в его толще (рис. 4-2). Толщина мембраны равна 7,5—8 нм.
Переход веществ через биологические мембраны осуществляется одним или несколькими
механизмами:
• простой диффузией через мембраны (низкий градиент концентрации);
• фильтрацией через поры мембран (наличие мембранных белков, формирующих в липидном
слое селективные и неселективные каналы);
• облегченной диффузией (наличие специфических белков-переносчиков);
• эндоцитозом (пиноцитозом) — активным транспортом, который включает процессы пе-
реноса, требующие затраты энергии, участия белков-переносчиков и протекающие против
градиента концентрации.
Диффузия. Скорость диффузии токсичных веществ через мембрану является функцией гра-
диента концентрации. При этом большее значение имеют площадь поверхности мембраны, ее
толщина и константа диффузии токсиканта. Константа диффузии соединения зависит от его
липофильности, молекулярной массы, пространственной конфигурации, степени диссоциации
(в случае слабого электролита).
Процесс диффузии, представленный на рис. 4-3, описывается законом Фика.
dQJB I dt=-DAd [Ств] / dt= - DA(CQ - С,),
| 1 В неравновесной термодинамике (естественной науке, занимающейся изучением динамики и эволюции систем в окружающем нас мире) термин «бифуркация» применяется для характеристики фундаментальной особенности поведе- ния сложных систем, подверженных сильным воздействиям и напряжениям в неравновесных состояниях и условиях. - Диссипативные системы — системы, полная энергия которых (сумма кинетической и потенциальной энергий) при движении убывает, переходя в другие виды энергии, например в теплоту, т.е. происходит диссипация энергии.
| где dQTB/dt — количество диффундирующего вещества за единицу времени (скорость диффу-
зии); D — коэффициент диффузии; А — площадь поверхности мембраны; d [Сп] / dt — гради-
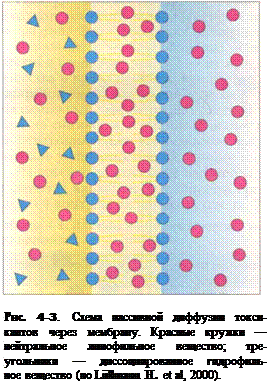 
ент концентрации токсичного вещества; (С„—С,) —
концентрация токсичного вещества снаружи и внут-
ри клетки.
Диффузия происходит в направлении падения
концентрации вещества, ведёт к равномерному рас-
пределению вещества по всему занимаемому им
объёму, не требует затрат энергии и возможна в
обоих направлениях (как в клетку, так и из нее).
С ростом молекулярной массы вещества коэффи-
циент диффузии заметно снижается. Липофильные
токсиканты свободно диффундируют через мембра-
ну. Малые полярные незаряженные молекулы, на-
пример, NH3, Н20, этанол также диффундируют с
достаточно большой скоростью.
Вещества с очень высокой липофильностью не
проникают через мембрану. Для всех ионизиро-
ванных молекул, независимо от размера, липидная
мембрана не проницаема. Гидрофильные токсикан-
ты не могут беспрепятственно преодолеть липидный
бислой мембраны. Транспорт таких молекул воз-
можен, во-первых, благодаря мембранным белкам,
формирующим в липидном слое каналы (поры),
заполненные водой. Механизмы проникновения
токсикантов при помощи фильтрации через поры
мембраны (неселективные и селективные каналы)
будут рассмотрены ниже. Во-вторых, наличие спе-
цифических белков-переносчиков (транслоказ), избирательно взаимодействующих с опреде-
ленными лигандами, облегчает их перенос через мембрану (облегченная диффузия). Скорость
транспорта веществ облегченной диффузией зависит от градиента концентраций переносимого
вещества и от количества белков-переносчиков в мембране.
Активный транспорт веществ через мембрану осуществляется против градиента концентра-
ции, с затратой энергии и при участии специализированных белков — пермеаз, встроенных в
мембрану. Механизм работы пермеазы заключается в специфическом связывании переносимо-
женным на внешней поверхности мембраны (см. рис. 4-4, I и 2). При этом часть рецептора, ко-
торая расположена в цитоплазме клетки, взаимодействует со специализированным белком (см.
рис. 4-4, 3), называемым адаптином (adaptine). Полученный комплекс токсиканта с рецептором
и белком мигрирует в определенную зону мембраны, на которой уже сконцентрировались другие
аналогичные комплексы, окаймленные специализированным белком — клатрином (clathrin), иг-
рающим одну из главных ролей при образовании везикул (см. рис. 4-4, 4). На следующем этапе
«окаймленные ямки» на определенных участках мембраны втягиваются в клетку, отделяются от
мембраны, образуя везикулы — пиноцитозные пузырьки (см. рис. 4-4, 5). Находясь внутри клет-
ки, везикула практически сразу теряет клатриновую оболочку (см. рис. 4-4, 6) и адаптины (см.
рис. 4-4, 7). Далее разрушается комплекс вещества с рецептором, который возвращается на свое
место на мембране (см. рис. 4-4, 8). Само же вещество (см. рис. 4-4, 9), попав во внутреннюю
область клетки, целенаправленно доставляется к месту назначения — ядру, аппарату Гольджи
или другим органеллам, не смешиваясь с другими макромолекулами клетки.
Экскреция макромолекул из клетки во внеклеточное пространство по аналогичному меха-
низму называется экзоцитоз.
Транспортные белки играют важнейшую роль в регуляции абсорбции, распределения
и экскреции многих токсикантов. Наиболее изученными среди них являются члены
семейства аденозинтрифосфатов (АТФ). Один из них — Р-гликопротеин — кодируется геном
человека АВСВ1, именуемым также MDR1. Основной функцией Р-гликопротеина является
энергозависимый трансмембранный транспорт очень многих токсикантов за счет гидролиза
АТФ (см. ниже). Далее в зависимости от рассматриваемых токсикантов будет даваться поясне-
ние о преобладающем механизме транспорта, действующем в том или ином случае.
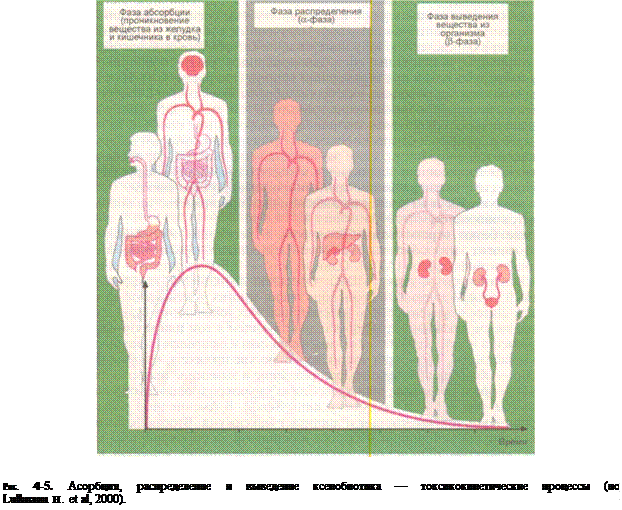
Начиная с момента поступления ксенобиотика в организм и оканчивая выведением вещества или
продуктов его метаболизма, происходят токсикокинетические процессы, которые можно разделить
на три фазы. Это — абсорбция (резорбция), распределение и выведение вещества (рис. 4-5).
Первая фаза — фаза абсорбции, или резорбции, характеризующаяся проникновением ве-
щества в кровь (см. рис. 4-5 — из желудка и кишечника). В течение этой фазы концентрация
вещества в крови постоянно возрастает и достигает максимума. Вторая фаза (а-фаза) — фаза
распределения вещества по органам и тканям в основном за счет кровотока характеризуется
максимальным эффектом воздействия токсиканта. Концентрация вещества в плазме крови
заметно снижается, в том числе за счет процессов биотрансформации. В течение третьей фазы
((3-фазы) осуществляется выведение вещества или его метаболитов из организма. В этот период
скорость уменьшения концентрации вещества в плазме крови снижается.

На токсикокинетические параметры ксенобиотика оказывают влияние природа токсиканта
и свойства биологических структур организма (табл. 4-1), значение которых будет показано
далее на конкретных примерах (см. гл. 7—11, электронное приложение).
Распределение. После абсорбции вещества попадают в кровь, а затем в органы и ткани.
Главной характеристикой распределения токсикантов в организме является неравномер-
ность.
Концентрацию вещества в плазме крови в любой момент времени t принято рассчитывать
по формуле:
C=C0-e-kt,.
где С — концентрация вещества в любой момент времени, моль/л; С(| — концентрация ве-
щества в момент введения, моль/л; К — константа элиминации; t — время, прошедшее после
введения вещества.
Для того чтобы рассчитать С0, нужно знать тот объем, в котором распределяется вещество.
Это и есть объем распределения, который не является физиологическим объемом и может быть
меньше, чем объем плазмы или крови, а для некоторых веществ — больше.
С0 равно количеству вещества в организме, деленному на объем распределения, поэтому
объем распределения характеризуется отношением общего содержания вещества в организме
к содержанию его в плазме.
Объем распределения (кажущийся объем распределения вещества) Vd — гипотетический
объем жидкостей организма, необходимый для равномерного распределения всей дозы по-
ступившего в организм вещества в концентрации, равной его концентрации в крови в момент
исследования.
Vd выражается в литрах на I кг массы и определяется соотношением:
V=D/C,
где V — объем распределения; D — доза вещества в молярной или массовой концентрации на
I кг массы тела; С — концентрация вещества в крови, моль/л.

Объем распределения характеризует степень проникновения веществ из плазмы крови и
внеклеточной жидкости в ткани и депонирования в них (табл. 4-2). Для липофильных соеди-
нений, легко проникающих через тканевые барьеры, характерно высокое значение Vd. Если
вещество в основном циркулирует в крови, Vd имеет низкие величины. Сильное связывание
молекул токсиканта тканями приводит при расчетах к большим значениям объема распреде-
ления.
Vd используют при определении константы элиминации и периода полужизни, или периода
полувыведения вещества t1/2.
Элиминация включает процессы, приводящие к снижению содержания чужеродного вещест-
ва в организме, т.е. биотрансформацию, депонирование и экскрецию. Экскреция — выведение
токсиканта и/или его метаболитов из организма во внешнюю среду без дальнейшего измене-
ния их химической структуры.
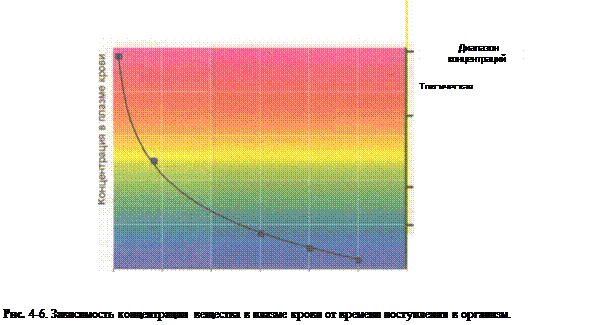
Основные количественные характеристики элиминации устанавливают по графику зависи-
мости концентрации вещества в крови (С) от времени, прошедшего после приема этого вещества
(t). Мерой скорости элиминации вещества является величина угла наклона касательной к кривой
(рис. 4-6), проведенной в интересующей исследователя точке. Скорость элиминации уменьшает-
ся с течением времени, поскольку уменьшается величина С. Однако неизменной характеристи-
кой процесса остается коэффициент пропорциональности КЕ. На рис. 4-6 показана зависимость
концентрации вещества в плазме крови от времени, прошедшего после его введения, а также
условные границы диапазона концентраций — от недействующих до токсических и выше.
| Терапевтическая
Условно действующая
Недействующая s Время
|
 Период полувыведения. Скорость выведения токсиканта характеризуется периодом полувы- Период полувыведения. Скорость выведения токсиканта характеризуется периодом полувы-
ведения t1/2 (или Т]/2).

Биодоступность неорганических веществ варьирует от 0,01 до 100% в зависимости от их
природы (см. гл. 8).
Клиренс (О) вещества определяется условным объемом плазмы крови (в литрах, миллилит-
рах), из которой вещество полностью удаляется за единицу времени (секунды, часы). Единицы
измерения С1 — л/с, л/мин, л/ч, а при расчете на единицу массы тела — л/(кгс), л/(кг-мин)
л/(кгч). О — величина, характеризующая индивидуальное вещество.
Общий клиренс (Cltot) объединяет все процессы, участвующие в элиминации.

Клиренс рассчитывается путем деления величины введенной дозы на величину площади под
кривой зависимости концентрации вещества в плазме крови от времени, прошедшего после
его введения. Следовательно, чем меньше О, тем медленнее вещество выводится из организма.
Можно рассчитать отдельно почечный клиренс, клиренс желчью или выдыхаемым воздухом с
учетом количества вещества, выделяемого через эти органы (табл. 4-4).
Период полувыведения является функцией объема распределения и скорости элиминации:
t|/2=ln2- Vd/Cltot.
Из уравнения следует, что чем больше объем распределения при одном и том же значении
клиренса, тем дольше выводится вещество из организма. Увеличение клиренса сокращает пе-
риод полувыведения. Соотношение между значениями клиренса, объема распределения и вре-
мени полувыведения вещества для однокамерной модели (см. ниже) выражается формулой:
С1, = К • V = =1п2 • \Л1П.
tot е d d' 1/2
Токсикокинетические параметры конкретных веществ рассматриваются во второй части кни-
ги (см. гл. 7—11) в связи с методами их обнаружения и определения в биологических объектах.
Камеры. Для измерения микро- и нанограммовых концентраций токсикантов используют
методы высокоэффективной жидкостной и газовой хроматографии, масс-спектрометрии, ра-
диоиммунного или иммуноферментного анализа, полярографии, спектрофотометрии и т.д. (см.
гл. 6). На основании полученных данных строят график, по оси абсцисс которого откладывают
время, а по оси ординат — концентрацию токсиканта в биологической пробе (наиболее часто
в плазме крови) в соответствующих единицах. Кривая «концентрация—время» характеризу-
ет токсикокинетические процессы, происходящие с исследуемым веществом (см. рис. 4-6).
На основе полученной зависимости строят токсикокинетические модели, используя специ-
альные компьютерные программы математического моделирования. В таких моделях принято
выделять компартменты (камеры, части), являющиеся условным отражением определенных
сред и тканей, в которые поступает токсикант. Расчет поведения токсиканта в многокамер-
ных моделях позволяет описывать и предсказывать динамику изменения его концентрации в
крови, моче, ликворе и тканях. Для математического моделирования токсикококинетических
процессов организм представляют в виде одной или нескольких частей (камер), ограниченных
проницаемой мембраной, в которых равномерно распределяется токсикант. Понятие «камера»
условно, так как за ним не стоит какое-либо анатомически ограниченное пространство; это
единица формализованной токсикокинетической системы.
| кожа, жир). В этих камерах в центральной и медленно —в пе-
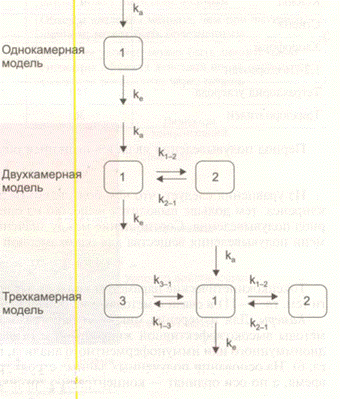
| Однокамерная модель, при которой организм представлен в виде единой гомогенной каме-
ры, — самая простая токсикокинетическая модель, пригодная для определения концентра-
ции токсиканта в плазме крови или моче. Такая модель предполагает, что изменения
концентрации токсиканта в плазме отражают изменения его содержания в тканях. Система
быстро достигает устойчивого динамического равновесия между поступлением токсиканта
в кровь и выходом из нее. Большинство токсикантов поступают в ткани и выходят из
них достаточно медленно. Согласно однокамерной модели, скорость выведения вещества
из организма постоянна, характеризуется константой выведения, или элиминации (КЕ), и
пропорциональна его концентрации, что противоречит результатам эксперимента и данным
исследований, полученных при изучении фармакокинетики лекарственных препаратов на
добровольцах. Наиболее приближены к реальности двух- и трехкамерные модели (рис. 4-8). За
центральную (обычно меньшую) камеру принимают плазму крови, составляющие ее элемен-
ты и хорошо перфузируемые органы (сердце, легкие, печень, почки, эндокринные железы),
за периферическую — плохо перфузируемые органы (мышцы
токсикант распределяется с разной скоростью: быстро
риферической, после чего частично выводится.
| Концентрация токсиканта быстро снижается из-за распределения по органам и тканям (а-фаза,
см. выше), т.е. по периферическим каме-
рам. Далее наступает (3-фаза — интенсивное
выведение токсиканта и его переход из пе-
риферической камеры снова в центральную
до тех пор, пока между камерами не насту-
пит состояние динамического равновесия.
Кинетика распределения вещества в такой
модели характеризуется тремя константами:
константой скорости выведения (кЕ), хонс-
тантой элиминации из центральной в пери-
ферическую камеру (к|2, к13), константой
перехода из периферических камер в цен-
тральную (к2 _,, к3|). Выводится токсикант
из организма только через центральную ка-
меру, периферические служат дополнитель-
ным резервуаром.
ка — коэффициент абсорбции токсикан-
та (константа скорости процесса абсорб-
ции токсиканта в камеру 1); к — коэффи-
циент выведения токсиканта (константа
скорости процесса выведения токсиканта
из камеры 1); к,_2—кзн — коэффициенты
скорости обмена веществ между камера-
ми (константы скорости процесса распре-
деления токсиканта между центральной и рис. 4-8. Камерные токсикокинетические модели. По-
периферическими камерами). яснение в тексте.
 Математическое моделирование предусмат- Математическое моделирование предусмат-
ривает прежде всего обоснование выбора ка-
мер и их числа, а также получение численных
значений коммуникационных констант. Для
выбора камер необходимы сведения о харак-
тере распределения токсиканта в организме и
скорости его выведения из органов и тканей.
Пример математического моделирования по-
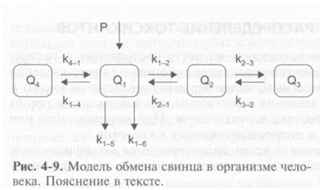
ведения свинца в организме человека.
При построении математической моде-
ли обмена свинца (рис. 4-9), так же, как
и других элементов, исходят из того, что
общие закономерности обмена в организме животных и человека (тип распределения, ос-
новные депонирующие органы) тождественны. Поэтому структура модели метаболизма
для человека принята аналогичной модели для лабораторных животных и состоит из 4 ка-
мер. Q, — камера, в которой концентрация ионов свинца, содержащегося в крови, посто-
янно увеличивается за счет ингаляционного и перорального поступлений (Р). Кровь — это
система транспорта, обеспечивающая поступление свинца в другие ткани (к2_, и к41), его
экскрецию из организма с мочой (к|5) и калом (k, _6). Q2 и Q3 — камеры, в которых кон-
центрация свинца соответствует его концентрациям в депонированных тканях. В костях
скелета определяют две концентрации элемента: в камере Q2 — лабильную, которая изме-
няется из-за постоянно идущих обменных процессов с кровью (к2_, и к, 2) и в камере Q3 —
относительно стабильную концентрацию, характеризующую долговременное депонирование
свинца в костях (см. гл. 8.5). Органы и ткани, не обладающие тропностью к свинцу, имеющие
близкие скорости обмена, объединены в камеру Q4.
Коммуникационные константы кн характеризуют скорости переноса свинца из камеры в
камеру, т.е. долю общего содержания токсиканта в камере, переносимую в единицу времени в
другую камеру. Модель, описывающая этот процесс, представляет систему линейных диффе-
ренциальных уравнений с постоянными коэффициентами и имеет вид:
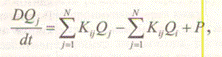
где Qi — содержание токсиканта в i-камере; к — коммуникационные константы скоростей
переноса токсиканта из одной камеры в другую; Р — скорость поступления токсиканта в кровь
извне; N — число блоков модели.
Поскольку интенсивность обменных процессов животных и человека существенно различа-
ются, то прямой перенос этих данных с животных на человека невозможен. Численные значе-
ния коммуникационных констант определяют на основании данных литературы, полученных
при обследовании лиц, контактирующих с различными концентрациями свинца в воздушной
среде, и лиц контрольной группы (см. гл. 8.5 и электронное приложение).
Коммуникационные константы модели, предложенные B.C. Безелем, приведены ниже:
к,_2 = 0,32+0,05;
к2_, = 0,34±0,04;
к3_2 = 2,35±0,2;
к4_, = 35±0,35;
к,_4 = 2,8±0,48;
к5_, = 0,84±0,24;
к,_5 = 0,0021+0,0005.
Проверка адекватности приведенной модели путем сопоставления реальных клинических
наблюдений и данных, полученных расчетным путем, показала, что прогноз, получаемый с
помощью предложенной модели, находится в хорошем соответствии с результатами, полу-
ченными при обследовании лиц, контактирующих с различными концентрациями свинца в
воздушной среде, и лиц контрольной группы.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
|




